Informacje ogólne
Definicja
- Rak nerki (RCC) stanowi ok. 80–90% wszystkich guzów nerek1.
- W około połowie przypadków guz jest wykrywany przypadkowo podczas badania radiologicznego/ultrasonograficznego1.
- W momencie rozpoznania ok. 25% chorych ma przerzuty. U 1/3 pacjentów, u których przeprowadzono wycięcie zlokalizowanej zmiany chorobowej, dochodzi do nawrotu.
- Guz Wilmsa, mięsaki i inne rzadkie postacie nie są tutaj omawiane.
Stadia wg UICC (Union for International Cancer Control)2
- Klasyfikacja TNM do określania stopnia zaawansowania raka nerki jest stosowana zarówno w kontekście klinicznym, jak i badawczym. System TNM był kilkakrotnie zmieniany. Poniższe informacje oparte są na publikacji z 2016 r. (klasyfikacja według UICC), zalecanych także w wytycznych European Association of Urology z 2025 r.3
- Stadium TX - nie można ocenić guza pierwotnego
- Stadium T0 - nie można stwierdzić guza pierwotnego
- Stadium T I
- guz ≤7 cm w największym wymiarze w obrębie torebki nerkowej
- podgrupa A: guz ≤4 cm w obrębie torebki nerkowej
- podgrupa B: guz >4 cm ale ≤7 cm w obrębie torebki nerkowej
- guz ≤7 cm w największym wymiarze w obrębie torebki nerkowej
- Stadium T II
- guz >7 cm w największym wymiarze w obrębie torebki nerkowej
- podgrupa A: guz 7–10 cm w obrębie torebki nerkowej
- podgrupa B: guz >10 cm w obrębie torebki nerkowej
- guz >7 cm w największym wymiarze w obrębie torebki nerkowej
- Stadium T III
- szerzenie się z przebiciem torebki nerkowej, w świetle dużych żył, lub z naciekiem tkanki tłuszczowej okołonerkowej, bez naciekania nadnercza, nie przekracza powięzi Geroty
- podgrupa A: naciekanie żyły nerkowej, nadnerczy lub okołonerkowej tkanki tłuszczowej (w tym. tłuszcz wnękowy), ale nieprzekraczający powięzi Geroty
- podgrupa B: naciekanie żył nerkowych lub żyły głównej dolnej poniżej przepony
- podgrupa C: naciekanie żyły głównej dolnej powyżej przepony
- szerzenie się z przebiciem torebki nerkowej, w świetle dużych żył, lub z naciekiem tkanki tłuszczowej okołonerkowej, bez naciekania nadnercza, nie przekracza powięzi Geroty
- Stadium T IV
- rozprzestrzenienie guza przez powięź Geroty
- NX - nie można ocenić regionalnych węzłów chłonnych
- N0: brak dowodów na zajęcie sąsiednich węzłów chłonnych
- N1: przerzuty w sąsiednich węzłach chłonny
- M0: brak dowodów na obecność przerzutów odległych
- M1: stwierdza się przerzuty odległe
Częstość występowania
- W Polsce w 2022 r. nowotwory złośliwe nerki4:
- U mężczyzn stanowił 3,7%, a u kobiet 2,3% zachorowań na wszystke nowotwory.
- Zachorowało 3298 mężczyzn i 2141 kobiet.
- Zmarło 1350 mężczyzn i 891 kobiet.
- Standaryzowany współczynnik zachorowalności (ESP2013) na 100 000 wynosił u mężczyzn 20, a u kobiet 10,3.
- Z rakiem nerki żyło 28,5 tysiąca mężczyzn.
- Płeć i wiek
- Stosunek liczby mężczyzn do liczby kobiet wynosi 2–3:1.
- Mediana wieku zachorowania wynosi 50–70 lat, a 30% osób dotkniętych tą chorobą ma mniej niż 60 lat5.
- Choroba rzadko rozpoczyna się przed 40. rokiem życia.
- średni wiek zachorowania
- mężczyźni 68
- kobiety 72.
- W momencie rozpoznania ok. 25% chorych ma przerzuty odległe, głównie w płucach, kościach lub węzłach chłonnych, rzadziej w mózgu, wątrobie, kanale kręgowym, jelitach lub jądrach6.
- Kilka ostatnich badań wskazuje na niewielki wzrost zapadalności raka nerki. Zakłada się, że roczny wzrost na całym świecie i w Europie wynosi ok. 2%.7
- Po skorygowaniu względem wieku, zapadalność powoli spada. Wzrost liczby przypadków wynika ze zmian demograficznych.
- Rosnące wykorzystanie nowoczesnych metod badań obrazowych doprowadziło do tego, że coraz więcej nowotworów nerki jest wykrywanych przypadkowo. Guzy te są zwykle mniejsze i niższego stopnia8.
Etiologia i patogeneza
- Nieznana
- Rak nerki rozwija się w nabłonku nerkowym, zwykle w kanalikach proksymalnych. Guzy są silnie unaczynione, prawdopodobnie z powodu zwiększonej produkcji czynnika wzrostu śródbłonka naczyniowego.
- Typ komórek i wzorzec histologiczny maja niewielkie znaczenie dla wyboru metody leczenia.
Typy guzów
- W 80‒90% guzów nerki to rak jasnokomórkowy (Clear Cell Renal Cell Carcinoma - ccRCC).
-
Powstaje w bliższym odcinku kanalika krętego.
- Za 60% przypadków raka nerki są prawdopodobnie odpowiedzialne uszkodzenia w genie VHL9.
- Mogą one być częścią choroby von Hippla.
- Charakterystyczne sa jasne komórki z nagromadzeniem glikogenu i lipidów.
-
- Rak brodawkowaty nerki
- Onkocytoma lub barwnikooporny rak nerki
- Powstaje z komórek wtrąconych w kanalikach nerkowych.
- Onkocytoma jest łagodniejszym wariantem nowotworu i występuje w 4% wszystkich nefrektomii wykonywanych z powodu podejrzenia raka nerki.
- Wariant barwnikooporny raka nerki stanowi 4% wszystkich raków nerki i może mieć łagodny przebieg, jeśli interwencja chirurgiczna zostanie przeprowadzona we wczesnym stadium.
- Rak nerki pochodzący z kanalika zbiorczego nerki
- Stanowi on mniej niż 1% wszystkich raków nerki i jest zazwyczaj guzem agresywnym.
- Należy odróżnić raka nerki od raka miedniczki nerkowej.
- Rak miedniczki nerkowej rozwija się z nabłonka dróg moczowych, a nie z komórek nerki.
- Pod względem biologicznym rak miedniczki nerkowej jest porównywalny z rakiem pęcherza moczowego.
Czynniki predysponujące
- Palenie papierosów podwaja ryzyko i wiąże się z bardziej zaawansowanym stadium w momencie rozpoznania13
- około 50 pacjentów z rakiem nerkowokomórkowym to obecni lub byli palacze.3
- Otyłość
- BMI >35 w porównaniu do BMI <25 kg/m2, współczynnik ryzyka (HR): 1,71.3
- Nadciśnienie tętnicze
- Rzadkie zaburzenia dziedziczne
- Narażenie zawodowe na niektóre węglowodory, azbest, kadm, ołów, rozpuszczalniki chlorowane.
ICD-10
- C64 Nowotwór złośliwy nerki z wyjątkiem miedniczki nerkowej
Profilaktyka
- Najbardziej efektywne zapobieganie to: unikanie palenia papierosów, zwiekszenie aktywności fizycznej i zmniejszenie otyłości.3
Diagnostyka
Kryteria diagnostyczne
- W niektórych przypadkach występują objawy i wyniki wskazujące na chorobę:
- hematuria (krwiomocz)
- ból w boku
- niedokrwistość oraz
- podwyższony poziom OB
- Rozpoznanie przy użyciu obrazowania diagnostycznego, takiego jak USG i angio-TK.
- Większość przypadków wykrywana przypadkowo za pomocą metod obrazowania zleconych z innych powodów
- Częste przypadkowe wykrycie podczas badania moczu lub badania ultrasonograficznego jamy brzusznej.
Rozpoznanie różnicowye
- Lite zmiany w nerce są uważane za nowotwór nerki, dopóki nie zostanie udowodnione inaczej.
Wywiad lekarski
- Choroba przez długi czas przebiega bezobjawowo, symptomy są nieswoiste i mogą objawiać się jako nietypowe zespoły.
- objawy ogólne: gorączka, osłabiony ogólny stan fizyczny
- objawy miejscowe: makroskopowy krwiomocz (30–40%), ból brzucha (ok. 50%), ból w boku (20–40%)
- objawy paraneoplastyczne (5–10%): policytemia, ektopowa produkcja hormonów, hiperkalcemia, amyloidoza
- objawy przerzutowe (25–40%): kaszel, ból kostny, ból głowy, utrata masy ciała, niedokrwistość.
Badanie fizykalne
- Badanie przedmiotowe zwykle jest w normie.
- Guz rzadko można wyczuć palpacyjnie.
- Triada bólu w boku, krwiomoczu i obecności guza w jamie brzusznej występuje tylko w 10‒15% przypadków.
- Ogólny stan fizyczny?
- Ograniczenia czynnościowe?
Badanie uzupełniające w praktyce lekarza rodzinnego
- Badanie moczu: Krwiomocz jest najczęstszym wynikiem patologicznym.
- Poszczególne badania krwi, takie jak szybkość sedymentacji erytrocytów OB >100, CRP, wapń w surowicy, hemoglobina i fosfataza alkaliczna mają znaczenie prognostyczne.
Diagnostyka u specjalisty
- USG
- Uwidacznia proces ekspansji guza litego.
- Angio-TK (lub RM)
- Najlepiej nadają się do badań diagnostycznych.
- Zapewniają najlepszą wizualizację guza i informacje dotyczące jego stopnia zaawansowania: regionalne węzły chłonne, naciekanie na żyłę nerkową, przerzuty do wątroby.
- Scyntygrafia układu kostnego i RTG/TK klatki piersiowej
- Te badania są wykonywane w celu poszukiwania przerzutów.
- Do badania guzów nerek rzadko stosuje się biopsję igłową.
- Metoda ta jest szczególnie przydatna, jeśli celem jest uniknięcie zabiegu chirurgicznego (np. w przypadku podejrzenia onkocytomy) oraz jeśli pacjent ma tylko jedną funkcjonującą nerkę.
Wskazania do skierowania
- Skierowanie do urologa
- Obrazowanie nerki wykazuje masę.
- krwiomocz (patrz poniżej).
Podejrzenie raka nerki
- Klinicznie podejrzewa się raka nerki przy następujących objawach, występujących pojedynczo lub łącznie:
- Krew w moczu
- pierwszy krok to wykluczenie raka pęcherza moczowego
- Jest to również główny objaw nowotworu nerki.
- ból w boku
- wyczuwalny guz/masa w jamie brzusznej
- Krew w moczu
-
Przy podejrzeniu uwzględniać grupy ryzyka
-
narażenie na rozpuszczalniki organiczne
-
2% osób dotkniętych tą chorobą ma skłonności dziedziczne.
Leczenie
Cele terapii
- Wyleczenie
- Leczenie paliatywne
Ogólne informacje o leczeniu
- Jedyną efektywną metodą leczenia raka nerki jest operacja.
- Podstawową metodą leczenia miejscowego raka nerki jest nefrektomia, która może być skuteczna w 90% przypadków1.
- Wskaźnik 5-letniego przeżycia wynosi 76% u mężczyzn i 77% u kobiet.
Leczenie choroby miejscowej
Radykalna nefrektomia
- Jedyną metodą leczenia raka nerki jest operacja.
- Miejscowo odgraniczone guzy T1/2 coraz częściej mogą być operowane z zachowaniem nerki. Standardowym leczeniem jest otwarte, częściowe wycięcie nerki. Coraz częściej są stosowane minimalnie inwazyjne techniki chirurgiczne.
- Najczęściej stosowane metody to nefrektomia radykalna (całkowite usunięcie nerki) lub nefrektomia częściowa (oszczędzająca miąższ nerkowy), rzadko możliwe usunięcie samego guza.
- Jeśli leczenie oszczędzające nerki nie jest możliwe, należy wykonać minimalnie inwazyjną nefrektomię15.
- W przypadku tradycyjnej nefrektomii radykalnej usuwana jest cała nerka, w tym powięź Geroty, nadnercze i regionalne węzły chłonne16.
- W piśmiennictwie nie ma dowodów na większą skuteczność którejkolwiek z metod. Otwarta operacja przezbrzuszna, otwarta operacja zaotrzewnowa i techniki laparoskopowe wydają się prowadzić do porównywalnie dobrych wyników pod względem przeżywalności17.
- Rutynowa adrenalektomia nie jest konieczna, chyba że guzy znajdują się w górnym biegunie nerki lub są duże.
- Wycięcie węzłów chłonnych powinno być wykonywane przy tkance okołowęzłowej. Rozszerzona limfadenektomia nie jest konieczna, jeśli nie ma klinicznego lub radiologicznego podejrzenia przerzutów do węzłów chłonnych18.
- Wskaźniki przeżywalności zależne od stadium guza
- We włoskim badaniu objęto 702 osoby leczone z powodu raka nerki w latach 1976‒2000. Około 2/3 z nich przeszło radykalną nefrektomię. Wskaźnik 5-letniego przeżycia wynosił 97,4% w stadium pT1a, 92,5% w T1b i 89,3% w pT219.
- Więcej informacji na temat rokowania przeżycia w przypadku raka nerki można znaleźć w sekcji Rokowanie.
- Naciekanie nowotworowe występują w 4–10% przypadków. W 90% przypadków znajduje się poniżej przepony. W 50% przypadków występują przerzuty do węzłów chłonnych i/lub przerzuty odległe.
- Pacjenci z naciekaniem nowotworowym poddawani są radykalnej nefrektomii w skojarzeniu z kilkoma specjalnymi procedurami (chirurgia naczyniowa/operacja wątroby).
- Guzy T4: naciekanie sąsiednich narządów: rokowanie jest niekorzystne, a interwencja chirurgiczna powinna być oceniana indywidualnie.
Powikłania przy nefrektomii
- Powikłania pooperacyjne opisywane są w 15‒30% przypadków po radykalnej nefrektomii20.
- Po częściowej nefrektomii ogólny odsetek powikłań wynosi 20‒25%21.
- Ponowne operacje potrzebne u 0–3% przypadków.
- Najczęstszymi powikłaniami śródoperacyjnymi są urazy śledziony i krwotoki.
- Krwawienie zwykle pochodzi z żyły nadnerczowej, patologicznych naczyń obocznych guza lub z żył lędźwiowych.
- Poważne krwawienie, w tym krwawienie wymagające transfuzji, konieczne jest w 1‒2% przypadków radykalnej nefrektomii21.
- Wskaźniki transfuzji w przypadku częściowej nefrektomii korelują ujemnie z doświadczeniem chirurgów. W zależności od badania, transfuzje wykonywano nawet w 50% przypadków21.
- Najczęstsze niechirurgiczne powikłania pooperacyjne to porażenie jelit, zakażenie rany i zapalenie płuc.
- Według islandzkiego badania opublikowanego w 2003 roku, śmiertelność okołooperacyjna wynosiła 2‒3% i nie uległa zmianie w ciągu 30-dniowego okresu obserwacji22.
- Zgodnie z amerykańskim badaniem opublikowanym w 2003 roku, częstość występowania powikłań w przypadku operacji guzów T3b-c wynosi 20‒30%, a 30-dniowa śmiertelność 2‒8%23.
Procedury niszczące guza
- Krioablacja, ablacja prądem o częstotliwości radiowej i wysokoskoncentrowane ultradźwięki (HIFU) powinny być stosowane wyłącznie w badaniach prospektywnych.
Terapia adjuwantowa
- Badania nad szczepionkami adjuwantowymi, np. z napromieniowanymi komórkami nowotworowymi, nie były w stanie wykazać żadnych korzyści terapeutycznych24.
- Terapia adjuwantowa cytokinami nie zwiększa wskaźnika przeżycia.
Leczenie choroby z przerzutami
- W momencie rozpoznania nawet 30% chorych ma przerzuty.
- Mediana przeżycia swoista dla nowotworu wynosi wówczas 7 miesięcy, a 5-letnie przeżycie wynosi 0–20%25.
- 80% przerzutów jest wieloogniskowych. Zwykle narządem przerzutowym jest płuco i wraz z układem kostnym to najczęstsze umiejscowienie pojedynczych przerzutów.
- Wcześniej stosowane leki immunoterapeutyczne takie jak interferon i interleukina wydłużały przeżycie, z medianą ok. 1 i 1,5 roku.
- Wprowadzenie inhibitorów VGEF i inhibitorów mTOR (patrz poniżej) doprowadziło do znacznego wydłużenia mediany czasu przeżycia.
Operacja w przypadku pierwotnej choroby przerzutowej
- Nefrektomia cytoredukcyjna ma jedynie charakter paliatywny i polega na usunięcie jak największej ilości tkanki nowotworowej z nerki i przerzutów, w celu zmniejszenia obciążenia nowotworowego organizmu.
- Nefrektomia cytoredukcyjna przed terapią immunologiczną interferonem znacząco wydłuża przeżycie w porównaniu z samą immunoterapią.
- Nie jest jasne, czy dotyczy to również substancji celowanych stosowanych obecnie w ramach standardowej terapii.
- Nefrektomia cytoredukcyjna jest opcją tylko wtedy, gdy ogólny stan fizyczny pacjenta jest dobry.
- Całkowite chirurgiczne usunięcie przerzutów przyczynia się do korzystniejszego rokowania26.
- To, czy miejscowe leczenie przerzutów jest opcją, zależy od liczby przerzutów i zajętych narządów, a także od czasu wystąpienia przerzutów.
Radioterapia
- Może zapewnić znaczną ulgę w bólu w przypadku przerzutów do tkanek miękkich, układu kostnego lub mózgu.
- U pacjentów z rozwijającym się, niepotwierdzonym biopsją, bezprzerzutowym rakiem, u których zabieg chirurgiczny nie jest możliwy, można przeprowadzić SBRT (stereotactic body radiotherapy; radioterapia stereotaktyczna ciała).3
Farmakoterapia w stadiach zaawansowanych lub z przerzutami
- Leki hamujące angiogenezę
- inhibitory kinazy tyrozynowej (TKI) receptora VEGF, np.:
- axytynib
- sunitynib
- pazopanib
- cabozantynib
- lenwatynib
- tywozanib
- przeciwciała blokujące VEGF, +np.:
- inhibitory mTOR, +np.:
- Inhibitory angiogenezy opóźniają progresję/wydłużają życie u pacjentów z dobrym lub średnim rokowaniem.
- Opracowanie terapii sekwencyjnych lub skojarzonych z inhibitorami mTOR i VGEF
- Przed rozpoczęciem leczenia należy rozważyć wykonanie nefrektomii cytoredukcyjnej.
- inhibitory kinazy tyrozynowej (TKI) receptora VEGF, np.:
- Terapia immunologiczna
- cytokiny
- Interferon alfa i interleukina-2 wykazały ogólny odsetek odpowiedzi na poziomie 8‒26% z całkowitą remisją w 27% przypadków.
- Długoterminowy wskaźnik odpowiedzi jest niski, a średni czas do progresji wynosi 10 miesięcy.
- Nie ma dowodów na to, że schemat skojarzony interferonu alfa i interleukiny-2 skutkuje wyższym odsetkiem odpowiedzi.
- Wielu pacjentów nie toleruje leczenia z powodu reakcji niepożądanych.
- Reakcje niepożądane występują częściej w przypadku interleukiny-2.
- Przed rozpoczęciem leczenia należy rozważyć wykonanie nefrektomii cytoredukcyjnej.
- Od czasu wprowadzenia inhibitorów angiogenezy i inhibitorów immunologicznych punktów kontrolnych, terapia cytokinami straciła na znaczeniu i powinna być prowadzona w wyspecjalizowanych ośrodkach.
- W przypadku jasnokomórkowego raka nerki z przerzutami nie należy stosować terapii cytokinowej opartej wyłącznie na podskórnym IL-2 i/lub IFN-a (IIa/A).
- inhibitory immunologicznych punktów kontrolnych
- Uwalniają limfocyty T do ataku komórki nowotworowej.
- Przeciwciało monoklonalne niwolumab, które jest skierowane przeciwko receptorowi PD-1, okazało się skuteczniejsze pod względem całkowitego przeżycia i jest lepiej tolerowane w terapii drugiego rzutu w porównaniu z ewerolimusem27.
- W badaniu z randomizacją i grupą kontrolną skojarzenie niwolumabu i ipilimumabu w leczeniu pierwszego rzutu poprawiło przeżycie całkowite w porównaniu z sunitynibem28.
- inne substancje o udowodnionej skuteczności: pembrolizumab, avelumab
- Więcej informacji na temat wskazania można znaleźć w poniższej ramce z wytycznymi.
- cytokiny
- chemioterapia
- Rak nerki zwykle nie reaguje na konwencjonalne leki cytostatyczne.
- Chemoterapia paliatywna nie powinna być stosowana w przypadku raka jasnokomórkowego nerki z przerzutami.
- Leczenie hormonalne nie przynosi żadnych efektów.
Dalsze leczenie
- Nowe metody w fazie testów
- inne zabiegi celowane molekularnie
- przeszczep komórek macierzystych wykazał sprzeczne wyniki.
- szczepionki przeciwnowotworowe
- leczenie antygenem.
Leczenie paliatywne
- Ból
- Nudności i wymioty
- Zaparcia
- Dolegliwości w obrębie jamy ustnej
- Niedożywienie i odwodnienie
- Duszność
- Depresja
- Lęk
- Majaczenie
- Niedrożności przewodu pokarmowego o charakterze złośliwym
Przebieg, powikłania i rokowanie
Przebieg
- Początkowo tylko przebieg bezobjawowy, często przez dłuższy czas.
- W momencie rozpoznania ok. 25% pacjentów ma przerzuty odległe, głównie w płucach lub układzie kostnym.
- Przerzuty odległe mogą wystąpić po ponad 10 latach od nefrektomii wykonanej z powodu choroby miejscowej.
- Przebieg kliniczny przerzutowego raka nerki jest bardzo zróżnicowany i zwykle nieprzewidywalny w indywidualnych przypadkach.
Powikłania
- Przerzuty (płuca, układ kostny) — uwaga: złamania patologiczne!
Rokowanie
Wskaźnik przeżywalności i śmiertelności
- Wskaźnik względnego przeżycia 5-letniego u mężczyzn wynosi ok. 76%, a u kobiet 77%.
- Bezwzględny wskaźnik 5-letniego przeżycia według stadium choroby
- mężczyźni
- łącznie 61,3%
- miejscowo odgraniczony guz 85,5%
- regionalnie rozprzestrzeniony guz 52,9%
- przerzuty odległe 8,7%
- kobiety
- łącznie 66,9%
- miejscowo odgraniczony guz 86,9%
- regionalnie rozprzestrzeniony guz 46,3%
- przerzuty odległe 12,6%
- mężczyźni
Czynniki predysponujące do złego rokowania
- Przerzutowy rak nerki
- słaby ogólny stan fizyczny
- podwyższony poziom LDH
- niskie stężenie hemoglobiny
- wysoki wapń w surowicy
Dalsze postępowanie
Obserwacja kontrolna w zależności od ryzyka nawrotu choroby
- Wszyscy pacjenci z niskim ryzykiem nawrotu są początkowo poddawani badaniu przedmiotowemu i badaniom laboratoryjnym co 3 miesiące przez pierwsze pół roku. Następnie badania wykonywane są co pół roku, a później co roku w ciągu 5 lat od zakończenia terapii. USG jamy brzusznej wykonuje się w odstępach co 3, 6, 12, 18, 36 i 60 miesięcy, TK klatki piersiowej w 12., 24. i 48. miesiącu, a TK jamy brzusznej standardowo w 24. i 48. miesiącu.
- W przypadku średniego i wysokiego ryzyka nawrotu procedury obrazowania są wykonywane jeszcze częściej i przez okres 9 lat.
Informacje dla pacjentów
Informacje dla pacjentów w Deximed Medibas
Leczenie łagodzące w zaawansowanym nowotworze
- Opieka paliatywna
- Leczenie lęku
- Nudności i wymioty
- Zaparcia
- Suchość błony śluzowej jamy ustnej
- Trudności z oddychaniem
- Utrata masy ciała w chorobie nowotworowej
- Depresja
- Majaczenie
Ilustracja
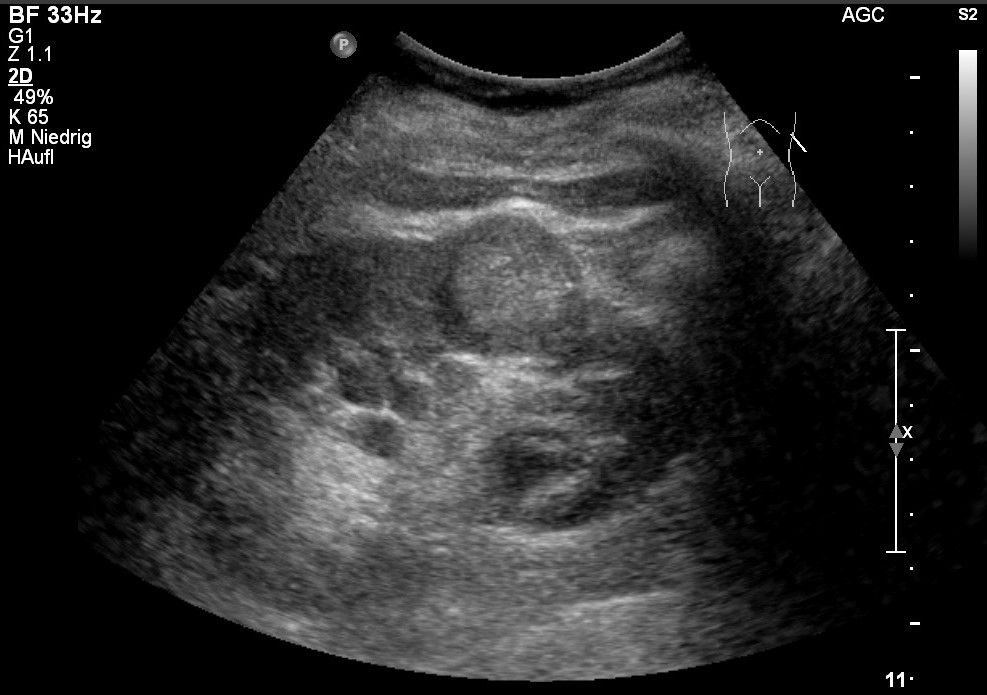
Ultrasonografia: rak nerkowokomórkowy; hiperechogeniczna masa z hipoechogenicznym brzegiem (za uprzejmością sonographiebilder.de ©Albertinen-Diakoniewerk e. V., Hamburg).
Źródła
Wytyczne
- Bex A, Ghanem YA, Albiges L, et al. European Association of Urology Guidelines on Renal Cell Carcinoma: The 2025 Update. Eur Urol. 2025 Jun;87(6):683-696. doi: 10.1016/j.eururo.2025.02.020. Epub 2025 Mar 20. PMID: 40118739. EurUrol
Piśmiennictwo
- Pessoa R, Kim S. Renal cell carcinoma. BMJ Best Practice; last reviewed: 12 Dec 2020, last updated 14 Oct 2020 bestpractice.bmj.com
- Brierley JD, Gospodarowicz MK, Wittekind C (Hrsg.). TNM Classification of Malignant Tumours, 8th Edition. Hoboken, NJ, USA: Wiley-Blackwell 2016. www.wiley.com
- Bex A, Ghanem YA, Albiges L, et al. European Association of Urology Guidelines on Renal Cell Carcinoma: The 2025 Update. Eur Urol. 2025 Jun;87(6):683-696. www.europeanurology.com
- Wojciechowska U, Didkowska JA, Barańska K, et al. Nowotwory złośliwe w Polsce w 2022 roku. Narodowy Instytut Onkologii. Warszawa 2024. onkologia.org.pl
- McLaughlin JK, Lipworth L. Epidemiologic aspects of renal cell cancer. Semin Oncol 2000; 27: 115-123. PubMed
- van der Poel HG, Roukema JA, Horenblas S, van Geel AN, Debruyne FM. Metastasectomy in renal cell carcinoma: A multicenter retrospective analysis. Eur Urol. 1999;35(3):197-203. doi: 10.1159/000019849. PMID: 10072620. PubMed
- European Association of Urology. Guidelines on Renal Cell Carcinoma. Ljungberg B, Albiges L, Bensalah A. et al. EAU; 2017 uroweb.org
- Beisland C, Medby PC, Beisland HO. Renal cell carcinoma: gender difference in incidental detection and cancer-specific survival. Scand J Urol Nephrol 2002;36(6):414 PubMed
- Kim WY, Kaelin WG. Role of VHL gene mutation in human cancer. J Clin Oncol 2004; 22: 4991-5004. PubMed
- Beck SD, Patel MI, Snyder ME, et al. Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma. Ann Surg Oncol 2004; 11: 71-7. PubMed
- Gunawan B, von Heydebreck A, Fritsch T, et al. Cytogenetic and morphologic typing of 58 papillary renal cell carcinomas: evidence for a cytogenetic evolution of type 2 from type 1 tumors. Cancer Res 2003; 63: 6200-5. PubMed
- Lubensky IA, Schmidt L, Zhuang Z, et al. Hereditary and sporadic papillary renal carcinomas with c-met mutations share a distinct morphological phenotype. Am J Pathol 1999; 155: 517-26. PubMed
- Cumberbatch MG, Rota M, Catto JW, La Vecchia C. The Role of Tobacco Smoke in Bladder and Kidney Carcinogenesis: A Comparison of Exposures and Meta-analysis of Incidence and Mortality Risks. Eur Urol 2016 Sep; 70(3): 458-66. pmid:26149669 PubMed
- European Society of Medical Oncology. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Stand 2019. www.esmo.org
- MacLennan S, Imamura M, Lapitan MC, et al. Systematic review of oncological outcomes following surgical management of localized renal cell carcer. Eur Urol 2012; 61:972-93. pubmed.ncbi.nlm.nih.gov
- Robson CJ, Churchil BM, Anderson W. Results of radical nephrectomy for renal cell carcinoma. J Urol 1969; 101(3): 297. PubMed
- Wille AH, Roigas J, DeGer S et al. Laparoscopic radical nephrectomy: techniques, results and oncological outcome in 125 consecutive cases. Eur Urol 2004 Apr;45(4):483. PubMed
- Blute ML, Leibovich BC, Cheville JC et al. A protocol for performing extended lymph node dissection using primary tumor pathological features for patients treated with radical nephrectomy for clear cell renal cell carcinoma. J Urol 2004 Aug;172(2):465. PubMed
- Ficarra V, Novara G, Galfano A, et al. Application of TNM, 2002 version, in localized renal cell carcinoma: is it able to predict different cancer-specific survival probability? Urology 2004 Jun;63(6):1050. PubMed
- Stephenson AJ, Hakimi AA, Snyder ME et al. Complications of radical and partial nephrectomy in a large contemporary cohort. J Urol 2004 Jan;171:130. PubMed
- Kunath F, Schmidt S, Krabbe LM, Miernik A, Dahm P, Cleves A, Walther M, Kroeger N. Partial nephrectomy versus radical nephrectomy for clinical localised renal masses. Cochrane Database Syst Rev. 2017 May 9;5(5):CD012045. pubmed.ncbi.nlm.nih.gov
- Thoroddsen A, Gudbjartsson T, Jonsson E, et al. Operative mortality after nephrectomy for renal cell carcinoma. Scand J Urol Nephrol 2003 Nov;37:507. PubMed
- Bissada NK, Yakout HH, Babanouri Aet al. Long-term experience with management of renal cell carcinoma involving the inferior vena cava. Urology 2003 Jan;61:89. PubMed
- Jocham D, Richter A, Hoffmann L et al. Adjuvant autologous renal tumor vaccine and risk of tumor progressionin patents with renal-cell carcinoma after radical nephrectomy:phase III, randomized controlled trial. Lancet 2004 Feb 21; 363:594. PubMed
- Leibovich BC, Han KR, Pantuck AJ et al. Scoring algorithm to predict survival after nephrectomy and immunotherapy in patients with metastatic renal cell carcinoma.Cancer 2003 Dec 15; 98:2566. PubMed
- Swanson DA. Surgery for metastases of renal cell carcinoma. Scand J Surg 2004; 93:150. PubMed
- Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med 2015; 373:1803-13. PMID: 1510665 PubMed
- Powles T, Albiges L, Staehler M et al. Updated European Association of Urology Guidelines Recommendations for the Treatment of First-line Metastatic Clear Cell Renal Cancer. Eur Urol 2017 Dec 7. pmid:29223605 PubMed
- Cheville JC, Lohse CM, Zincke H, Weaver AL, Blute ML. Comparisons of outcome and prognostic features among histologic subtypes of renal cell carcinoma. Am J Surg Pathol 2003; 27: 612-24. PubMed
- Peyromaure M, Misrai V, Thiounn N, et al. Chromophobe renal cell carcinoma: analysis of 61 cases. Cancer 2004; 100: 1406-10. PubMed
- Motzer RJ. Renal cell carcinoma: a priority malignancy for development and study of novel therapies. J Clin Oncol 2003; 21: 1193-4. PubMed
- Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356: 125-134. PubMed
- Childs R, Chernoff A, Contentin N, et al. Regression of metastatic renal-cell carcinoma after nonmyeloablative allogeneic peripheral-blood stem-cell transplantation. N Engl J Med 2000; 343: 750-8. New England Journal of Medicine
- Srinivasan R, Barrett J, Childs R. Allogeneic stem cell transplantation as immunotherapy for nonhematological cancers. Semin Oncol 2004; 31: 47-55. pubmed.ncbi.nlm.nih.gov
- Motzer RJ, Mazumdar M, Bacik J, Berg W, Amsterdam A, Ferrara J. Survival and prognostic stratification of 670 patients with advanced renal cell carcinoma. J Clin Oncol 1999; 17: 2530-40. PubMed
- Motzer RJ, Bacik J, Schwartz LH, et al. Prognostic factors for survival in previously treated patients with metastatic renal cell carcinoma. J Clin Oncol 2004; 22: 454-63. PubMed
Autorzy
- Tomasz Tomasik (recenzent)
- Thomas M. Heim (redaktor/recenzent)
- Dirk Nonhoff (redaktor/recenzent)