Informacje ogólne
Definicja
- Definicja zawału mięśnia sercowego (myocardial infarction) według ESC/ACC/AHA/WHF Task Force for the Universal Definition of Myocardial Infarction1
- Ostry zawał mięśnia sercowego
- Stwierdzenie martwicy mięśnia sercowego (wzrost poziomu troponiny) przy obrazie klinicznym ostrego niedokrwienia mięśnia sercowego.
- Przebyty zawał mięśnia sercowego
- Obecność patologicznych załamków Q z objawami lub bez objawów przy braku przyczyn innych niż niedokrwienne.
- Uwidocznienie ubytku żywego mięśnia sercowego w badaniach obrazowych, odpowiadające etiologii niedokrwiennej.
- Ostry zawał mięśnia sercowego
- Definicja ostrego zespołu wieńcoweo (acute coronary syndrome - ACS) wdług ESC: spektrum schorzeń u pacjentów prezentujących niedawne zmiany w objawach klinicznych, którym mogą (ale nie muszą) towarzyszyć zmiany w 12-odprowadzeniowym EKG lub stężeniu (podwyższenie) troponiny sercowej.2
- Pacjenci z podejrzeniem ACS mogą być zdianozowani jaki ostry zawał mięśnia sercowego lub niestabilna dławica piersiowa.
Klasyfikacja zawału mięśnia sercowego na podstawie badania EKG2
- Podział przypadków ostrego zawału mięśnia sercowego na 2 grupy na podstawie wyników EKG:
- Zawał z uniesieniem odcinka ST lub STEMI (ST Elevation Myocardial Infarction)
- zazwyczaj spowodowany całkowitą zakrzepową niedrożnością naczynia.3
- Zawał bez uniesienia odcinka ST lub NSTEMI (Non ST Elevation Myocardial Infarction)
- spowodowany częściową niedrożnością naczynia lub całkowitą niedrożnością z krążeniem obocznym.3
- Zawał z uniesieniem odcinka ST lub STEMI (ST Elevation Myocardial Infarction)
Epidemiologia
- Choroby układu krążenia są najczęstszą przyczyną zgonów w krajach uprzemysłowionych, ale także w krajach rozwijających się.
- Częstość występowania zawału mięśnia sercowego w ciągu całego życia wynosi około 5%.
- Wzrost częstości występowania zawału mięśnia sercowego wraz z wiekiem z 1–2% u osób w wieku 40–49 lat do około 10% u osób w wieku 70–79 lat. Skorygowana o wiek częstość występowania zawału mięśnia sercowego z roku na rok maleje, zwłaszcza u mężczyzn.
- Rocznie w Polsce hospitalizowanych jest około 90 tysięcy chorych z zawałami serca – z uniesieniem odcinka ST (STEMI) (ok. 1/3) i bez uniesienia odcinka ST (NSTEMI) (ok. 2/3).4
- W USA i Europie współczynnik umieralności spada od połowy lat 90. XX wieku.5
- W krajach rozwijających się spodziewany jest gwałtowny wzrost śmiertelności z powodu chorób sercowo–naczyniowych.6
- Częstość występowania zawału mięśnia sercowego jest odwrotnie zależna od mediany dochodu w danym kraju (odpowiednio 1,92/2,21/4,13 przypadków na 1000 osobo–lat w krajach o wysokim/średnim/niskim dochodzie).3
- Ponad 80% wszystkich zgonów z powodu chorób układu krążenia ma obecnie miejsce w krajach rozwijających się.3
Etiologia
Miażdżyca
- Jest przyczyną około 90% zawałów.6
- Czynnikiem wyzwalającym jest pęknięcie blaszki miażdżycowej z wytworzeniem skrzepliny.
- Uwaga: decydującymi czynnikami wystąpienia zawału są skład i podatność blaszki miażdżycowej, a nie jej wielkość czy stopień zwężenia.7
- Wysokotłuszczowe, miękkie blaszki są bardziej niebezpieczne niż blaszki twarde, ponieważ łatwiej pękają i mają większy potencjał trombogenny po pęknięciu.7
Zator
- Czynnik sprawczy około 3% ostrych zawałów.8
- Najczęstszą przyczyną jest migotanie przedsionków, inne przyczyny to kardiomiopatie, choroby zastawek, infekcyjne zapalenie wsierdzia, nowotwory złośliwe i zator skrzyżowany z powodu przetrwałego otworu owalnego (patent foramen ovale – PFO)/ubytku przegrody międzyprzedsionkowej (atrial septal defect –ASD).8
Skurcz
- Niedrożność/zamknięcie naczynia spowodowane przez nadreaktywne komórki mięśni gładkich i dysfunkcję śródbłonka.9
- Skurcz jest odpowiedzialny za 1–1,5% przyjęć do szpitala z powodu dławicy piersiowej.
Inne przyczyny
- Rzadsze przyczyny to zapalenia naczyń, rozwarstwienia aorty, narkotyki, anomalie naczyń wieńcowych, urazy.6
Patogeneza
- Najczęściej proces patofizjologiczny rozpoczyna się od pęknięcia niestabilnej blaszki miażdżycowej z wytworzeniem skrzepliny.
- Niedrożność naczynia, a tym samym brak równowagi między zapotrzebowaniem mięśnia sercowego na tlen a jego podażą w obszarze zaopatrzenia niedrożnego naczynia.
- Kaskada zmian biochemicznych i komórkowych prowadzi do szybkiego upośledzenia czynności mięśnia sercowego, a w dalszym przebiegu ostatecznie do martwicy.
- Znaczne zaburzenia ruchomości ścian mogą wystąpić już po 60 sekundach.6
- Nieodwracalne uszkodzenie mięśnia sercowego następuje od 20 minut do kilku godzin od początku zaburzeń perfuzji.6
- Strefa zawału przemieszcza się falowo od wnętrza serca do nasierdzia i do stref granicznych obszaru zagrożonego zawałem (area at risk).10
- Rozległość zawału zależy od:10
- wielkości obszaru niedokrwienia
- czasu trwania (i ewentualnie okresowego ustępowania) niedrożności naczynia wieńcowego
- obecności krążenia obocznego
- stopnia dysfunkcji mikronaczyniowej.
- Reperfuzja jest konieczna, aby uratować niedokrwiony mięsień sercowy i ograniczyć strefę zawału.
- Z drugiej strony nie tylko niedokrwienie, ale i reperfuzja per se paradoksalnie prowadzi do nasilenia uszkodzenia mięśnia sercowego i zaburzeń krążenia.10
- Testowano różne mechaniczne i farmakologiczne strategie ograniczania uszkodzenia reperfuzyjnego, ale nie udało się jeszcze przełożyć badań eksperymentalnych ani proof–of–concept na praktykę kliniczną.10
- W dalszym przebiegu dochodzi do powstania martwicy skrzepowej (denaturacyjnej) z bliznowaceniem.
- Następnie dochodzi do ewentualnego rozszerzenia i zmiany kształtu komory w procesie gojenia, tzw. remodeling.
Przewlekłe czynniki ryzyka
- Zobacz także artykuł pierwotna profilaktyka chorób układu krążenia.
Modyfikowalne czynniki ryzyka
- W badaniu INTERHEART zidentyfikowano potencjalnie modyfikowalne czynniki predysponujące do wystąpienia zawału mięśnia sercowego.11
- Wzrost ryzyka z powodu:
- palenia papierosów
- cukrzycy
- nadciśnienia tętniczego
- otyłości brzusznej (stosunek obwodu talii do obwodu bioder)
- zwiększonego stosunku apoB/apoA1 (dyslipidemia)
- stresu psychospołecznego.
- Obniżenie ryzyka poprzez:
- codzienne spożywanie owoców i warzyw
- aktywność fizyczną
- ewentualnie umiarkowane spożywanie alkoholu.
- Wzrost ryzyka z powodu:
Niemodyfikowalne czynniki ryzyka
- Wiek
- Płeć
- Wywiad rodzinny
- Wzrost ryzyka wynikający z dodatniego wywiadu rodzinnego związany jest z:14
- Liczbą osób spokrewnionych, u których wystąpił zawał.
- Wiekiem, w którym wystąpił zawał u osób spokrewnionych (odwrotna zależność: im młodszy wiek krewnego, tym większe ryzyko).
- Wzrost ryzyka wynikający z dodatniego wywiadu rodzinnego związany jest z:14
Ostre czynniki ryzyka wystąpienia zawału mięśnia sercowego
- Ostre czynniki ryzyka to czynności lub okoliczności, które krótkotrwale i przejściowo mogą zwiększać ryzyko wystąpienia ostrego zawału mięśnia sercowego:15
- rytm okołodobowy: zwiększone ryzyko w godzinach porannych
- wysiłek fizyczny
- stres psychiczny
- ekspozycja na zimno
- aktywność seksualna
- spożycie dużej ilości alkoholu
- kawa
- kokaina
- nadmiernie obfite posiłki.
Inne czynniki ryzyka
- Inne czynniki mogą zwiększyć ryzyko, w tym:
- reumatoidalne zapalenie stawów i inne choroby reumatologiczne16
- ciężka łuszczyca17
- stosowanie NLPZ u pacjentów z chorobą wieńcową18-19
- wysokie tętno spoczynkowe20
- zakażenie wirusem grypy.21
ICD–10
- I21 Ostry zawał mięśnia sercowego.
- I21.0 Ostry zawał serca pełnościenny ściany przedniej.
- I21.1 Ostry zawał serca pełnościenny ściany dolnej.
- I21.2 Ostry zawał serca pełnościenny o innej lokalizacji.
- I21.3 Ostry zawał serca pełnościenny o nieokreślonym umiejscowieniu.
- I21.4 Ostry zawał serca podwsierdziowy.
- I21.9 Ostry zawał serca, nieokreślony.
- I22 Ponowny zawał serca.
- I22.0 Ponowny zawał serca ściany przedniej.
- I22.1 Ponowny ostry zawał serca ściany dolnej.
- I22.8 Ponowny ostry zawał serca o innej lokalizacji.
- I22.9 Ponowny ostry zawał serca o nieokreślonym umiejscowieniu.
- I23 Niektóre powikłania występujące w czasie ostrego zawału mięśnia sercowego.
- I23.0 Krwiak osierdzia jako powikłanie występujące w czasie ostrego zawału serca.
- I23.1 Ubytek przegrody międzyprzedsionkowej jako powikłanie występujące w czasie ostrego zawału serca.
- I23.2 Ubytek przegrody międzykomorowej jako powikłanie występujące w czasie ostrego zawału serca.
- I23.3 Pęknięcie ściany serca bez krwiaka osierdzia jako powikłanie występujące w czasie ostrego zawału serca.
- I23.4 Pęknięcie strun ścięgnistych jako powikłanie występujące w czasie ostrego zawału serca.
- I23.5 Pęknięcie mięśnia brodawkowatego jako powikłanie występujące w czasie ostrego zawału serca.
- I23.6 Skrzeplina w przedsionku, uszku przedsionka i komorze jako powikłanie występujące w czasie ostrego zawału serca.
- I23.8 Inne powikłania występujące w czasie ostrego zawału mięśnia sercowego.
- I25 Przewlekła choroba niedokrwienna serca.
- I25.2 Przebyty zawał serca.
Diagnostyka
Kryteria diagnostyczne
- Zawał mięśnia sercowego można pod względem patogenetycznym i klinicznym podzielić na pięć typów:1
- Typ 1: zawał mięśnia sercowego na tle choroby wieńcowej, zwykle wywołany pęknięciem blaszki miażdżycowej z całkowitą lub niepełną zakrzepową niedrożnością naczynia.
- Wzrost i/lub spadek troponiny z co najmniej jedną wartością powyżej normy i co najmniej jednym z następujących kryteriów:
- objawy niedokrwienia
- nowe zmiany w EKG o charakterze niedokrwiennym
- uwidocznienie patologicznych załamków Q w EKG
- diagnostyka obrazowa: nowe zaburzenia ruchomości ściany lub ubytek żywotnego mięśnia sercowego
- stwierdzenie skrzepliny wewnątrzwieńcowej.
- Wzrost i/lub spadek troponiny z co najmniej jedną wartością powyżej normy i co najmniej jednym z następujących kryteriów:
- Typ 2: zawał mięśnia sercowego spowodowany brakiem równowagi między zapotrzebowaniem na tlen a zaopatrzeniem tkanek mięśnia sercowego w tlen; z definicji niespowodowany pęknięciem blaszki miażdżycowej (czynniki wyzwalające, np. niedociśnienie, niedokrwistość, tachyarytmia lub bradyarytmia, zator, skurcz).
- Wzrost poziomu troponiny i inne kryteria jak w typie 1 (z wyjątkiem stwierdzenia skrzepliny).
- Typ 3: zgon sercowy z objawami i zmianami EKG świadczącymi o niedokrwieniu, zgon przed możliwością pobrania krwi lub przed wzrostem stężenia troponiny lub wykrycie zawału w sekcji zwłok.
- Typ 4: zawał mięśnia sercowego w związku z przezskórną interwencją wieńcową (PCI)
- Wzrost stężenia troponiny do poziomu przekraczającego 5–krotność górnej granicy normy wraz z uwidocznieniem zmian niedokrwiennych w EKG lub zmian w angiografii/obrazowaniu mięśnia sercowego.
- Typ 5: zawał mięśnia sercowego w związku z operacją wszczepienia bypassów (CABG)
- Wzrost stężenia troponiny do poziomu przekraczającego 10–krotność górnej granicy normy wraz z uwidocznieniem zmian niedokrwiennych w EKG lub zmian w angiografii/obrazowaniu mięśnia sercowego.
- Typ 1: zawał mięśnia sercowego na tle choroby wieńcowej, zwykle wywołany pęknięciem blaszki miażdżycowej z całkowitą lub niepełną zakrzepową niedrożnością naczynia.
Diagnostyka różnicowa
Schorzenia sercowo–naczyniowe
- Niestabilna dławica piersiowa (angina pectoris): ostry zespół wieńcowy (OZW) bez wzrostu troponiny.
- Zatorowość płucna.
- Zapalenie osierdzia (pericarditis).
- Kardiomiopatia stresowa (takotsubo).
- Tętniak aorty.
- Rozwarstwienie aorty.
- Zapalenie mięśnia sercowego (myocarditis).
- Zwężenie zastawki aortalnej (stenoza aortalna).
Inne choroby
- Płuca:
- Przewód pokarmowy:
- Ściana klatki piersiowej:
- zespół ściany klatki piersiowej (zespół Tietza)
- półpasiec
- złamanie żebra
- przerzuty do kości
- nerwoból.
- Zaburzenia lękowe.
- Zaburzenia depresyjne.
- Zespół Da Costy („nerwica serca”).
Wywiad lekarski
Możliwe objawy prodromalne
- Objawy prodromalne mogą wystąpić przed właściwym OZW u obu płci, częściej u kobiet22-23:
- osłabienie
- zaburzenia snu
- stany lękowe
- duszność
- łagodne dolegliwości w klatce piersiowej/dyskomfort w kończynie górnej.
Aktualny wywiad lekarski
- Ból w klatce piersiowej
- Główny objaw u 70% mężczyzn, ale tylko u 50% kobiet.24
- Typowy ból w klatce piersiowej ("stenokardialny"):25
- silny
- piekący, dławiący, gniotący lub ściskający
- występuje nagle
- lewostronny
- wyzwolony/nasilony przez wysiłek
- towarzyszą mu duszność, lęk.
- Możliwe promieniowanie do ramienia (ramion), szyi, żuchwy, nadbrzusza, barków.
- Poprawa po podaniu azotanów (nitrogliceryna) nie jest swoista dla niedokrwienia.26
- Duszność, niekiedy z towarzyszącym kaszlem.
- Nudności.
- Lęk, niepokój.
- Kołatanie serca, tachykardia.
- Zawroty głowy.
- Atypowe dolegliwości (np. izolowana duszność, dolegliwości podobne do dyspepsji) występują częściej:
- u kobiet
- u osób starszych
- w cukrzycy
- w niewydolności nerek
- w otępieniu.
- „Typowe” objawy nie stanowią potwierdzenia zawału, „nietypowe” go nie wykluczają!25
Wcześniejsze występowanie w wywiadzie
- Czynniki ryzyka sercowo–naczyniowego, w tym wywiad rodzinny.
- Rozpoznana wcześniej choroba wieńcowa, stan po zawale mięśnia sercowego.
- Inne choroby sercowo–naczyniowe.
- Leki.
Badanie fizykalne
Ocena
- Ogólny stan fizyczny.
- Lęk.
- Zaburzenia świadomości.
- Bladość, sinica.
- Zimne poty.
- Tachypnoe.
- Poszerzenie żył szyjnych.
Parametry życiowe
- Tętno
- częstość
- arytmia.
- Ciśnienie tętnicze
- Może być prawidłowe, podwyższone lub obniżone.
- W szczególności świeżo występujące niedociśnienie (hipotonia) może świadczyć o wstrząsie kardiogennym.
- Saturacja O2.
- Temperatura ciała
- Często wzrost temperatury w ciągu pierwszych 24–48 godzin.6
Osłuchiwanie
- Badanie osłuchowe często w normie.
- Możliwa tachykardia lub bradykardia.
- Ewentualnie trzeci ton serca.
- Ewentualnie szmer skurczowy przy niedomykalności zastawki mitralnej lub pęknięciu przegrody międzykomorowej.
- Zobacz również artykuł szmery nad sercem u dorosłych.
- Możliwe trzeszczenia nad płucami przy zastoju w krążeniu płucnym.
Postępowanie diagnostyczne lekarza rodzinnego w przypadku bólu w klatce piersiowej
- Ocena wstępna: czy istnieje zagrożenie dla życia pacjenta?
- Ocena prawdopodobieństwa choroby wieńcowej/OZW.
- Ewentualnie wyjaśnienie przyczyn pozasercowych.
Ocena wstępna: zagrożenie życia
- Wstępna ocena sytuacji opiera się na:
- Okoliczności konsultacji:
- pilna wizyta domowa
- zaniepokojenie rodziny.
- Pierwsze wrażenie dotyczące stanu chorego:
- Ukierunkowany wywiad lekarski/badanie dodatkowe:
- (bezpośrednio poprzedzające) omdlenie albo zasłabnięcie
- zimne poty
- objawy hemodynamiczne niewydolności krążenia (wskaźnik wstrząsowy = stosunek częstości tętna do ciśnienia skurczowego >1).
- Okoliczności konsultacji:
- W razie potrzeby należy udzielić pierwszej pomocy lub podjąć działania ratujące życie.
- Natychmiastowe działania ratujące życie i terapia objawowa, zobacz także artykuły:
- Monitorowanie w zależności od dostępnych możliwości.
- Zaalarmowanie służb ratowniczych – skierowanie do szpitala.
- W miarę możliwości EKG. Jednak prawidłowy zapis EKG w żadnym wypadku nie powinien oznaczać, że nie należy pilnie skierować pacjenta do szpitala w obecności ratownika medycznego, jeśli istnieje podejrzenie, że pacjent ma zawał serca.
- Prowadzenie dalszych działań diagnostycznych w miarę możliwości.
Ocena prawdopodobieństwa choroby wieńcowej/OZW
- Jeżeli parametry życiowe są prawidłowe należy dokonać oceny prawdopodobieństwa choroby wieńcowej/OZW jako najczęstszej przyczyny niebezpiecznego przebiegu, któremu można zapobiec.
- Prostym narzędziem oceny prawdopodobieństwa choroby wieńcowej jest skala Marburg Heart Score, która została opracowana dla lekarzy rodzinnych.
- Ocenia się 5 kryteriów (po 1 punkcie za każde kryterium):
- wiek/płeć (mężczyźni ≥55 lat i kobiety ≥65 lat)
- znana choroba naczyniowa
- narastanie bólu przy wysiłku
- ból nie jest wywołany podczas palpacji klatki piersiowej
- pacjent podejrzewa, że przyczyną jest choroba serca.
- Prawdopodobieństwo choroby wieńcowej:
- 0–1 punkt: bardzo niskie (<1%)
- 2 punkty: niskie (5%)
- 3 punkty: średnie (25%)
- 4–5 punktów: wysokie (65%).
- Wiele wytycznych zaleca klasyfikację Diamonda i Forrestera do oceny prawdopodobieństwa choroby wieńcowej przy wstępnej ocenie (kryteria: wiek, płeć, klasyfikacja dławicy piersiowej, ostatnio również duszności), ale uzyskana ocena prawdopodobieństwa jest bardziej odpowiednia do stosowania w kardiologii niż w praktyce lekarza rodzinnego.
Tabela 1. Prawdopodobieństwo choroby wieńcowej – zmodyfikowana klasyfikacja Diamonda–Forrestera, na podstawie wytycznych ESC 2019 r. i Interna Szczeklika 2022 r.
| Wiek (lata) | 30–39 | 40–49 | 50–59 | 60–69 | ≥70 |
| Płeć | M K | M K | M K | M K | M K |
| Typowa dławica piersiowa | m m | d u | d u | d d | d d |
| Atypowa dławica piersiowa | m m | u u | d u | d u | d d |
| Ból niedławicowy | m m | m m | u m | d u | d u |
|
K – kobiety; M – mężczyźni Prawdopodobieństwo : m – małe <5% (badania dodatkowe tylko w szczególnych przypadkach); u – umiarkowane 5 – 15% (badania dodatkowe można rozważyć); d – duże > 15% (preferowane wykonanie badań dodatkowych). |
|||||
Ocena prawdopodobieństwa wystąpienia ostrego zespołu wieńcowego (OZW)
- Pacjentów z pośrednim lub wysokim prawdopodobieństwem choroby wieńcowej (Marburg Heart Score >2 punkty) należy ocenić pod kątem prawdopodobieństwa OZW.
- Kryteria, które przemawiają za OZW:
- niedawne wystąpienie dolegliwości w spoczynku
- czas trwania dolegliwości w spoczynku >20 minut
- dławica piersiowa narastająca (crescendo angina)
- pacjent czuje się inaczej niż zwykle
- niepokój pacjenta
- zimne poty
- bladość.
- Kryteria, które przemawiają przeciwko OZW:
- Ból w klatce piersiowej nie jest faktycznym powodem konsultacji.
Badania uzupełniające
- Decydującymi badaniami dodatkowymi potwierdzającymi wstępne rozpoznanie w przypadku klinicznego podejrzenia OZW są: EKG oraz wyniki badań laboratoryjnych – troponina sercowa (w Polsce nie jest badaniem wykonywanym w POZ).
EKG
- EKG 12–odprowadzeniowe należy wykonać jak najszybciej w przypadku podejrzenia OZW, najlepiej w czasie < 10 min. Jeśli jednak prawdopodobieństwo OZW przed badaniem jest wysokie, prawidłowe EKG nie powinno przesądzać o zaniechaniu dalszych działań – odsetek fałszywie ujemnych wyników EKG jest wysoki.
- Należy przeanalizować EKG pod kątem (zobacz również EKG – lista kontrolna):
- Zmiany w odcinku ST–T
- utrzymujące się uniesienia odcinka ST
- obniżenie odcinka ST
- ujemne załamki T.
- Załamki Q
- przebyty zawał mięśnia sercowego lub już zaawansowany ostry zawał mięśnia sercowego.
- Inne możliwe zmiany w EKG:
- blok odnogi pęczka Hisa
- częstoskurcze komorowe/skurcze dodatkowe
- częstoskurcze nadkomorowe/skurcze dodatkowe
- bloki przedsionkowo–komorowe, bloki SA (zatokowo–przedsionkowe).
- Ewentualnie wykonać EKG z dodatkowymi odprowadzeniami, aby rozpoznać zawał ściany tylnej (odprowadzenia V7–V9) lub prawokomorowy (odprowadzenia V3R–V4R).
- Arytmie – np. wystąpienie po raz pierwszy migotania przedsionków.
- Zmiany w odcinku ST–T
- U objawowych pacjentów z początkowo niediagnostycznym EKG należy wykonać kolejne badania EKG.
- W miarę możliwości porównanie z poprzednimi zapisami EKG.
Objawy ostrego niedokrwienia mięśnia sercowego w badaniu EKG1
- Uniesienie odcinka ST
- Wystąpienie po raz pierwszy uniesienia odcinka ST w punkcie J w 2 kolejnych odprowadzeniach należy uznać za istotne:
- we wszystkich odprowadzeniach oprócz V2–V3: ≥0,1 mV
- odprowadzenia V2–V3: ≥0,2 mV u mężczyzn ≥40. roku życia, ≥0,15 mV u kobiet.27
- Wystąpienie po raz pierwszy uniesienia odcinka ST w punkcie J w 2 kolejnych odprowadzeniach należy uznać za istotne:
- Obniżenia odcinka ST i zmiany załamka T
- Wystąpienie po raz pierwszy poziomego lub zstępującego obniżenia odcinka ST ≥0,05 mV w 2 kolejnych odprowadzeniach i/lub ujemny załamek T ≥0,1 mV w 2 kolejnych odprowadzeniach z wyraźnym załamkiem R lub R/S >1.
Objawy przebytego zawału mięśnia sercowego w badaniu EKG1
- Załamek Q w odprowadzeniach V2–V3 ≥0,02 s lub zespół QS w odprowadzeniach V2 i V3.
- Załamek Q ≥0,03 s i ≥0,1 mV lub zespół QS w odprowadzeniach I, II, aVL, aVF lub V4–V6 w 2 odprowadzeniach.
- Załamek R ≥0,04 s w odprowadzeniach V1–V2 i R/S ≥1 ze zgodnym dodatnim załamkiem T (jeśli nie ma zaburzeń przewodzenia).
Troponina
- Obecnie w ocenie uszkodzenia mięśnia sercowego dominują oznaczenia troponiny sercowej (I lub T).
- Sercowe troponiny I i T ulegają ekspresji niemal wyłącznie w mięśniu sercowym.
- Oznaczanie CK MB, niegdyś dominujące, ma obecnie drugorzędne znaczenie.
- Wzrost poziomu troponiny wskazuje na uszkodzenie mięśnia sercowego, ale samo w sobie nie pozwala określić, jaki mechanizm leży u jego podstaw.1
- Wzrost poziomu troponiny definiuje się jako wartość powyżej 99 percentyla dla ogólnej populacji.1
- Wzrost po 1–3 godzinach, szczyt po 12–96 godzinach, normalizacja w ciągu 1–2 tygodni.
- Preferowane oznaczanie przy użyciu wysokoczułych testów troponinowych (high sensitivity):28
- Wysoka negatywna wartość predykcyjna.
- Krótszy interwał „nieczuły na troponinę”, wzrost około 1 godziny po wystąpieniu objawów w przypadku stosowania wysokoczułych testów na troponinę.
- W izbie przyjęć/na SORze można stosować szybkie algorytmy (rule in/rule out).
- Interpretacja jako marker ilościowy (nie tylko „dodatni” lub „ujemny”).
- Im wyższa wartość pomiarowa, tym większe prawdopodobieństwo, że przyczyną jest zawał mięśnia sercowego.
- Testy point–of–care (szybkie testy troponinowe, wykonywane w miejscu opieki nad pacjentem) w praktyce lekarza rodzinnego są przydatne tylko wtedy, gdy uwzględni się ich ograniczenia.
- Niższa czułość.
- Niższa ujemna wartość predykcyjna.
- Należy uwzględnić kilkugodzinny okres opóźnienia do wystąpienia wzrostu troponiny. Jeśli test troponinowy został wykonany wcześniej, należy go powtórzyć, gdy występują odpowiednie objawy kliniczne. Ujemny wynik testu troponinowego w żadnym przypadku nie powinien oznaczać, że dalsze działania nie są konieczne, jeżeli występują typowe objawy kliniczne.
- W miastach z dobrze rozwiniętym systemem ratownictwa medycznego oznaczanie troponiny wydaje się zwykle zbędne. Jeśli odległość do najbliższej pracowni hemodynamiki jest bardzo duża, a od początku objawów upłynęło kilka godzin, oznaczenie troponiny może stanowić cenną wskazówkę co do ewentualnego występowania ostrego zespołu wieńcowego.
Algorytm rule in/rule out
- Zastosowanie testów o wysokiej czułości do oznaczeń troponiny skróciło czas do wykrycia/wykluczenia NSTEMI (rule in/rule out) w warunkach klinicznych.
- Dotychczas zalecano algorytm 0–3 godziny (czyli oznaczenie troponiny przy przyjęciu i 3 godziny później).26
- W nowych wytycznych ESC zaleca się stosowanie algorytmu 0–1 godziny (alternatywnie 0–2 godziny).28
- Skrócony czas do rozpoznania, krótszy pobyt w Izbie Przyjęć/na SORze.
- Lekarze powinni mieć świadomość, że oznaczenie troponiny nie zastępuje badania podmiotowego ani EKG.29
Rozpoznanie na podstawie obrazu klinicznego, EKG i oznaczenia troponiny
- Przed rozpoczęciem dalszej diagnostyki wstępna ocena powinna być oparta na obrazie klinicznym, zmianach w EKG oraz wartościach troponiny.
- Troponinę należy interpretować jako marker ilościowy: im wyższy poziom troponiny, tym większe prawdopodobieństwo ostrego zawału mięśnia sercowego jako przyczyny.28
- Typowy obraz kliniczny i badania dodatkowe26
- STEMI: silny, często typowy "stenokardialny" ból w klatce piersiowej (ewentualnie wstrząs kardiogenny, stan po resuscytacji), uniesienia odcinka ST, troponina wyraźnie podwyższona.
- NSTEMI: typowe lub atypowe dolegliwości o różnym nasileniu, zmiany w odcinku ST–T (jednak prawidłowe EKG u ponad 1/3 pacjentów z NSTEMI), podwyższenie troponiny od nieznacznego po istotne.
- Inne przyczyny sercowe (np. kardiomiopatia takotsubo, tachyarytmia): łagodne, nietypowe lub „typowe” dolegliwości, zmiany w odcinku ST–T, troponina nieznacznie podwyższona.
- Niestabilna dławica piersiowa: typowe lub nietypowe dolegliwości, ze zmianami w odcinku ST–T lub bez, troponina w normie.
- Przyczyna pozasercowa (np. zespół ściany klatki piersiowej, zapalenie płuc): dolegliwości raczej nietypowe, brak zmian w EKG, troponina w normie.
Alternatywne przyczyny podwyższenia poziomu troponiny28
- Tachyarytmia.
- Niewydolność serca.
- Przełom nadciśnieniowy.
- Poważne choroby (sepsa, wstrząs).
- Zapalenie mięśnia sercowego (myocarditis).
- Kardiomiopatia takotsubo.
- Zdekompensowane wady zastawek (np. zwężenie zastawki aortalnej).
- Rozwarstwienie aorty.
- Zatorowość płucna.
- Niewydolność nerek.
- Udar niedokrwienny mózgu/udar krwotoczny mózgu.
- Choroby naciekowe (np. amyloidoza, sarkoidoza).
- Nadczynność/niedoczynność tarczycy.
- Ekstremalny sport wytrzymałościowy.
Diagnostyka specjalistyczna
Echokardiografia
- Badanie echokardiograficzne powinno być rutynowo dostępne na oddziałach ratunkowych/oddziałach „szybkiej diagnostyki bólu w klatce piersiowej”.28
- Echokardiografię należy wykonać u pacjentów z NSTEMI.28
- Ocena globalnej i regionalnej kurczliwości lewej komory.
- Diagnostyka różnicowa.
- Po wykluczeniu ostrego zawału w razie potrzeby echokardiografia wysiłkowa w dalszym przebiegu w celu potwierdzenia/wykluczenia choroby wieńcowej.
RM
- Przydatny w indywidualnych przypadkach w celu potwierdzenia diagnostyki różnicowej (np. zapalenie mięśnia sercowego, kardiomiopatia takotsubo).
- Może być rozważony w przypadku niejednoznacznego wyniku badania echokardiograficznego.
TK
- Służy głównie do potwierdzenia chorób w diagnostyce różnicowej (zatorowość płucna, rozwarstwienie aorty).
- TK należy rozważyć jako alternatywę dla badań inwazyjnych w przypadkach niskiego lub umiarkowanego prawdopodobieństwa choroby wieńcowej i niejednoznacznego wyniku EKG i/lub testu troponinowego.
- Opcja nieinwazyjnego wykluczenia lub wykrycia choroby wieńcowej po wykluczeniu ostrego zawału u pacjentów z niskim ryzykiem.28,30
Obrazowanie wewnątrznaczyniowe
- W celu ukierunkowania i zoptymalizowania PCI należy rozważyc metody obrazowania wewnątrznaczyniowego np. ultrasonografię wewnątrznaczyniową (IVUS) lub tomografię koherentną optyczną (OCT).
Koronarografia
- W ostrym zespole wieńcowym koronarografia z ewentualną przezskórną interwencją wieńcową (PCI), czas wykonania zależny od stratyfikacji ryzyka.
- Do zmiennych uwzględnionych w stratyfikacji ryzyka według skali GRACE należą: wiek, skurczowe ciśnienie tętnicze, tętno, kreatynina w surowicy, klasa niewydolności serca według Killipa, troponina oraz zmiany odcinka ST.
- Cele koronarografii:26
- ostateczne potwierdzenie/wykluczenie całkowitej lub częściowej niedrożności naczyń wieńcowych
- rozpoznanie zmiany powodującej zawał
- kwalifikacja układu wieńcowego do PCI lub pomostowania aortalno–wieńcowego (coronary artery bypass grafting – CABG)
- stratyfikacja ryzyka
- po wykonaniu koronarografii, ewentualnie PCI (przezskórna interwencja wieńcowa) z implantacją stentu.
Wskazania do hospitalizacji
- Natychmiastowe przyjęcie pacjentów z podejrzeniem OZW (ostrego zespołu wieńcowego).
- Celem jest zminimalizowanie opóźnień w łańcuchu ratunkowym.
- Wezwanie pomocy przez pacjenta lub bliskich (zwiększenie świadomości poprzez kampanie informacyjne).
- Pierwszy kontakt z personelem medycznym (lekarz pogotowia, lekarz rodzinny)
- Cel: jak najkrótszy czas do momentu przybycia pacjenta do pracowni hemodynamiki, jeśli istnieje wysokie prawdopodobieństwo ostrego zespołu wieńcowego.
- Placówka medyczna, np. oddział „szybkiej diagnostyki bólu w klatce piersiowej”
- W przypadku przedszpitalnego rozpoznania STEMI – bezpośredni transport do pracowni hemodynamiki (oszczędność czasu około 20 minut).
- W przypadku pierwszego przyjęcia do szpitala bez pracowni hemodynamiki, docelowy czas do dalszego przeniesienia ≤30 minut (door–in/door–out).
Leczenie
Cele leczenia
- Złagodzenie ostrych objawów.
- Ograniczenie do minimum uszkodzenia mięśnia sercowego.
- Ponowne udrożnienie naczynia w ostrej niedrożności tętnic wieńcowych.
- Zapobieganie ostrej niewydolności serca.
- Zapobieganie powikłaniom zawału.
- Zapobieganie nawrotowi zawału.
- Zapobieganie przewlekłej niewydolności serca.
- Zmniejszenie śmiertelności.
Pierwsza pomoc w ostrym zespole wieńcowym (OZW) w praktyce lekarza rodzinnego
- W ramach pierwszej pomocy zalecane jest następujące postępowanie:
- Ułożenie pacjenta w pozycji półwysokiej z uniesieniem górnej części tułowia pod kątem 30 stopni.
- Założenie dostępu dożylnego.
- Zapewnienie dostępu do defibrylatora.
- ASA 150–300 mg doustnie lub 75–250 mg dożylnie, jeśli pacjent nie przyjmuje tego leku na stałe.
- Nitrogliceryna (dawka aerozolu lub tabletka pod język), jeśli BP skurczowe >100 mmHg.
- Nie należy podawać azotanów pacjentom z niedociśnieniem, znaczną bradykardią lub tachykardią, zawałem prawej komory, znanym ciężkim zwężeniem aorty lub stosującym inhibitor fosfodiesterazy 5 w ciągu ostatnich 24–48 godzin.
- W przypadku silnego bólu morfina 5 - 10 mg dożylnie. W razie potrzeby powtarzać aż do ustąpienia bólu (w Polsce rzadko dostępna w POZ).
- W przypadku nudności (wywołanych opiatami) 10 mg metoklopramidu dożylnie lub 62 mg dimenhydrynatu dożylnie (aktualnie niedostępny w Polsce).
- Heparyna 5000 j.m. dożylnie lub enoksaparyna 1 mg/kg m.c. podskórnie przy występowaniu zmian w EKG związanych z niedokrwieniem lub podwyższonych enzymów sercowych (w Polsce rzadko dostępna w POZ).
- W przypadku bradykardii atropina 1 mg dożylnie, w razie potrzeby można powtarzać do 3 mg.
- Po przyjeździe karetki pogotowia: monitorowanie rytmu serca i podawanie tlenu (2–4 l/min.), w przypadku duszności lub innych objawów niewydolności serca, jeśli wysycenie tlenem <90%.
- Należy rozważyć miareczkowane podawanie opioidów dożylne w celu analgezji.
- U pacjentów z dużym nasileniem lęku należy rozważyć podanie łagodnego leku uspokajającego (benzodiazepiny).
- Skierowanie do oddziału kardiologii z założoną kaniulą dożylną (wenflonem).
- W przypadku przyjęcia w trybie pilnym należy skonsultować z kardiologiem interwencyjnym konieczność podania drugiego leku przeciwpłytkowego przed zabiegiem, pomimo, że takie postępowanie nie jest rutynowo stosowane.
- Preferowaną substancją jest tikagrelor w dawce nasycającej 180 mg doustnie.
- Społeczeństwo powinno być wyedukowane i posiadać wiedzę iż w przypadku wystąpienia objawów ostrego zespołu wieńcowego należy wezwać zespół ratownictwa medycznego.
- Konsultacja z lekarzem rodzinnym zamiast niezwłocznego telefonu na pogotowie może powodować opóźnienie przedszpitale w leczeniu.
Wytyczne dotyczące terapii w ostrym zespole wieńcowym2,28
Terapia reperfuzyjna
- STEMI
- Terapia reperfuzyjna jest wskazana u wszystkich pacjentów z początkiem objawów w okresie ≤ 12 godzin.
- Zalecenie pierwotnej PCI zamiast trombolizy jeśli czas od diagnozy jest < 120 min.
- Rozważenie rutynowej PCI jeśli czas od początku objawów wynosi 12-48 godz.
- Jeśli szybka PCI nie jest możliwa, zaleca się wykonanie trombolizy w ciągu 12 godzin od wystąpienia objawów.
- Terapia reperfuzyjna jest wskazana u wszystkich pacjentów z początkiem objawów w okresie ≤ 12 godzin.
- NSTEMI
- Natychmiastowa koronarografia/PCI przy bardzo wysokim ryzyku (w ciągu 2 godzin).
- Wczesna koronarografia/PCI przy wysokim ryzyku (w ciągu 24 godzin).
- Elektywna koronarografia/PCI przy niskim ryzyku po nieinwazyjnym wykryciu niedokrwienia lub wykryciu niedrożnej choroby wieńcowej w TK naczyń wieńcowych.
- Wybór stentu
- Zastosowanie DES (drug–eluting stents, stenty uwalniające lek) nowej generacji wykazuje przewagę pod względem bezpieczeństwa i efektywności w porównaniu z BMS (bare metal stents, stenty niepowlekane) i pierwszą generacją DES.31
Profilaktyka wtórna – leczenie przeciwzakrzepowe
- Po każdej postaci OZW (dławica piersiowa, NSTEMI lub STEMI) i niezależnie od początkowej terapii (zachowawcza, PCI lub CABG) należy stosować tikagrelor 90 mg 2 x dziennie przez 1 rok w uzupełnieniu ASA, pod warunkiem dobrej tolerancji i małego ryzyka krwawienia; pierwsza dawka tikagrelolu 180 mg.
- Jeśli tikagrelor nie jest tolerowany, należy stosować prasugrel w dawce 10 mg przez 12 miesięcy, a u pacjentów w wieku powyżej 75 lat i/lub o masie ciała poniżej 60 kg – 5 mg; pierwsza dawka prasugrelu 60 mg.
- U pacjentów z wysokim ryzykiem krwawienia można rozważyć odstawienie inhibitora P2Y12.
- Po 6 miesiącach od implantacji stentu.
- Po 1 miesiącu przy leczeniu zachowawczym.
- Potrójna terapia (DAPT + OAC) po wszczepieniu stentu
- ASA i klopidogrel jako leki przeciwpłytkowe (nie tikagrelor i prasugrel).
- U pacjentów wymagających doustnego leczenia przeciwkrzepliwego, którzy są poddawani PCI z powodu ostrego zespołu wieńcowego dowolnego rodzaju, obowiązują następujące zalecenia dotyczące czasu trwania potrójnej terapii:
- Przy DES dowolnego typu – 6 miesięcy potrójnej terapii; następnie NOAC + klopidogrel do 12 miesiąca, potem wyłącznie NOAC lub acenokumarol/ warfaryna.
- Przy BMS – 4 tygodnie potrójnej terapii, następnie terapia przeciwzakrzepowa wyłącznie acenokumarolem/warfaryną.
- W razie znacznie podwyższonego ryzyka krwawienia podawanie ASA można ograniczyć do 4 tygodni, a klopidogrelu – do 6 miesięcy.
- Na czas trwania potrójnej terapii podczas stosowania acenokumarolu/warfaryny należy utrzymywać wartość INR w dolnym zakresie terapeutycznym (np. 2,0–2,5).
- Klopidogrel + NOAC jako alternatywa u pacjentów z wysokim ryzykiem krwawienia.
- Odstawienie podwójnej terapii przeciwpłytkowej po 12 miesiącach, kontynuacja NOAC lub acenokumarol/warfaryna (INR 2–3).
- U pacjentów z wysokim ryzykiem krwawienia żołądkowo-jelitowego, którzy leczeni są podwójną terapią przeciwpłykową rekomendowany jest inhibitor pompy protonowej.
- Jeśli u pacjentów otrzymujących leczenie przeciwkrzepliwe konieczna jest interwencja wieńcowa, zamiast NOAC należy zastosować potrójną terapię z acenokumarolem lub warfaryną.
Profilaktyka wtórna – inne leki i styl życia
- Terapia statynami na stałe.
- Beta–bloker, jeśli LVEF ≤40%.
- Inhibitory ACE przy LVEF ≤40% (lub objawach niewydolności serca), nadciśnieniu tętniczym.
- Antagoniści aldosteronu przy LVEF ≤35% i niewydolności serca lub cukrzycy.
- Inhibitory SGLT-2 (sodium–glucose co-transporter 2) lub agoniści receptora GLP-1 (glucagon-like peptide-1) u pacjentów z cukrzycą, wysokim ryzykiem sercowo-naczyniowym, niewydolnością seca, przewlekłą chorobą nerek.
- Wszystkim pacjentom należy zalecić zmianę stylu życia (w tym zaprzestanie palenia, aktywność fizyczną, zdrowe odżywianie) (I/A).
- Coroczne szczepienie przeciw grypie.
Leczenie w szpitalu
- Etapy leczenia:
- leczenie objawowe bólu, duszności i lęku
- farmakoterapia okołozabiegowa
- PCI (przezskórna interwencja wieńcowa)
- leczenie powikłań
- profilaktyka wtórna: zmiana stylu życia, farmakoterapia, terapia z użyciem urządzeń.
Terapia objawowa
- Opioidy do uśmierzenia bólu
- Morfina prowadzi do opóźnienia jelitowego wchłaniania doustnych leków przeciwpłytkowych.26
- Pacjentom z dużym lękiem można podać benzodiazepinę.32
- Rutynowe podawanie azotanów nie jest już zalecane.32
- Podanie w nawracającej dławicy piersiowej, nadciśnieniu tętniczym lub objawach niewydolności serca.
- Rutynowe podawanie O2 nie jest już zalecane ze względu na możliwe działania niepożądane.33-34
- Podawanie O2 tylko przy saturacji <90%.
Terapia przeciwzakrzepowa
Leczenie przeciwkrzepliwe
- Leczenie należy rozpocząć w momencie rozpoznania.28
- Często stosuje się heparynę niefrakcjonowaną (70–100 j.m./kg m.c. dożylnie) i enoksaparynę (1 mg/kg m.c. podskórnie 2 x dziennie).35
Hamowanie agregacji płytek krwi (leczenie przeciwpłytkowe)
- W ostrym zespole wieńcowym (OZW) należy podać 150–300 mg ASA, jeśli nie wprowadzono tego leczenia już wcześniej; dawka podtrzymująca 75 mg/d.
- Czas podawania drugiego leku przeciwpłytkowego (dual antiplatelet therapy – DAPT) jest przedmiotem dyskusji. Decyzję zwykle podejmuje się po przyjęciu/rozpoznaniu w klinice lub w pracowni hemodynamiki.
- Drugim lekiem przeciwpłytkowym z wyboru jest tikagrelor 90 mg 2 x dziennie (przez 1 rok) w skojarzeniu z ASA.
- Można podawać prasugrel 10 mg dziennie, szczególnie u pacjentów ze STEMI.26
- Ze względu na niekorzystny stosunek korzyści do ryzyka pierwotne stosowanie prasugrelu tylko w przypadku nietolerancji tikagreloru.36
- Klopidogrel (75 mg 1 x dziennie) w OZW jest obecnie alternatywną opcją leczenia tylko u pacjentów z przeciwwskazaniami do stosowania tikagreloru i prasugrelu (stan po krwotoku mózgowym, wskazanie do OAC).
- Dawki nasycające inhibitorów receptora P2Y12 są wyższe od dawek potrzymujących, stosowanych przewlekle.
Dalsza farmakoterapia
- Beta–blokery
- Beta–blokery zmniejszają zużycie tlenu przez mięsień sercowy poprzez zmniejszenie częstości tętna, obniżenie ciśnienia tętniczego i kurczliwości.32
- U pacjentów stabilnych hemodynamicznie wczesne wprowadzenie beta–blokerów jest przydatne, jeśli utrzymują się objawy niedokrwienia.32
- Pacjenci, u których występuje zwiększone ryzyko wstrząsu kardiogennego (osoby starsze, tachykardia, BP skurczowe <120 mmHg) - beta-blokery mniej korzystne. 37-38
- Statyny
Rewaskularyzacja
PCI (przezskórna interwencja wieńcowa) oraz tromboliza
STEMI
- Pierwotna PCI w STEMI wykazuje więcej korzyści niż leczenie trombolityczne, które często stosowano w przeszłości.41-42
- Tromboliza, po której wykonuje się PCI, nie daje żadnych korzyści w porównaniu z pierwotną PCI.43
- Trombolizę należy zastosować w ciagu 12 godzin od wystąpienia objawów wtedy, gdy wykonanie pierwotnej PCI nie jest możliwe w krótkim czasie (<120 min).2,32
- Na wyniki leczenia u pacjentów ze STEMI wpływa czas do udanego udrożnienia naczynia.45-46
NSTEMI
- Wykazano korzyści z rutynowej strategii inwazyjnej z rewaskularyzacją pod postacią zmniejszenia:47-49
- śmiertelności
- ponownego zawału mięśnia sercowego
- ponownej hospitalizacji.
- Czas wykonania koronarografii/PCI w NSTEMI/niestabilnej dławicy piersiowej zależy od stratyfikacji ryzyka.28
- Natychmiastowa strategia inwazyjna (w czasie 2h)
- niestabilność hemodynamiczna lub wstrząs
- oporna na leczenie dławica piersiowa (ból)
- zagrażające życiu arytmie
- powikłania mechaniczne
- ostra niewydolność serca
- nawracające dynamiczne zmiany odcinka ST.
- Wczesna strategia inwazyjna (w czasie 24 h)
- Elektywna strategia inwazyjna przy niskim ryzyku
- Decyzja o badaniu inwazyjnym po wykonaniu badania w kierunku niedokrwienia lub TK naczyń wieńcowych.
- Natychmiastowa strategia inwazyjna (w czasie 2h)
Wybór stentu
- Zastosowanie DES nowej generacji wykazuje przewagę pod względem bezpieczeństwa i efektywności w porównaniu z BMS i pierwszą generacją DES.31
Dostęp naczyniowy
- Jeśli jest to technicznie możliwe, należy preferować dostęp promieniowy.24
- Dostęp promieniowy jest związany z mniejszą liczbą powikłań krwotocznych u pacjentów z OZW w porównaniu z dostępem udowym.50
Operacja wszczepienia bypassów wieńcowych (CABG)
- Pomostowanie aortalno–wieńcowe (coronary artery bypass graft – CABG) ma obecnie drugorzędne znaczenie w postępowaniu w OZW.
- Po zaopatrzeniu naczynia zawałowego lub w chorobie wielonaczyniowej, po stratyfikacja ryzyka, dyskusja/decyzja o dalszym postępowaniu odbywa się w „zespole sercowym” (heart team, kardiolodzy i kardiochirurdzy).
Profilaktyka wtórna
Podwójna terapia przeciwpłytkowa (dual antiplatelet therapy – DAPT)
- Pacjenci po zawale serca otrzymują ciągłą terapię przeciwpłytkową ASA.
- Wyjątkiem są pacjenci przyjmujący na stałe doustne leczenie przeciwzakrzepowe (OAC), u których po fazie potrójnej terapii można stosować przewlekle wyłącznie OAC (patrz poniżej, punkt potrójna terapia).
- DAPT z użyciem ASA i inhibitora P2Y12 jest wskazana zarówno po PCI, jak i u pacjentów leczonych zachowawczo po OZW.51
- Substancją preferowaną jako drugi lek przeciwpłytkowy w ostrym zespole wieńcowym jest obecnie tikagrelor (dawka podtrzymująca 90 mg 2 x na dobę).51
- Dotyczy to również pacjentów wcześniej leczonych klopidogrelem.51
- Po każdej postaci OZW (dławica piersiowa, NSTEMI albo STEMI) i niezależnie od początkowej terapii (zachowawcza, PCI lub CABG) należy stosować tikagrelor w dawce 90 mg 2 x na dobę przez 1 rok w uzupełnieniu ASA, pod warunkiem dobrej tolerancji.
- Prasugrel jako alternatywa w przypadku nietolerancji tikagreloru.36
- Jeśli tikagrelor nie jest tolerowany, należy zastosować prasugrel w dawce 10 mg przez 12 miesięcy, a u pacjentów w wieku powyżej 75 lat i/lub o masie ciała poniżej 60 kg w dawce 5 mg.
- W przypadku nietolerancji tikagreloru po operacji wszczepienia bypassów (CABG) należy stosować wyłącznie ASA.
- Prasugrel jako alternatywa w przypadku nietolerancji tikagreloru.36
- Czas trwania podwójnej terapii przeciwpłytkowej (DAPT) wynosi zazwyczaj 12 miesięcy, następnie stosuje się na stałe ASA.
- Jeśli ryzyko krwawienia jest wysokie, podwójną terapię przeciwpłytkową można skrócić do:51
- 6 miesięcy po wszczepieniu stentu
- 1 miesiąca przy leczeniu zachowawczym.
Potrójna terapia
- U pacjentów ze wskazaniem do doustnego leczenia przeciwkrzepliwego (najczęściej migotanie przedsionków lub zakrzepica), u których wykonuje się zabieg implantacji stentu, stosuje się potrójną terapię przez ograniczony czas.
- Ryzyko powikłań krwotocznych wzrasta wraz z liczbą stosowanych leków przeciwkrzepliwych.
- NNH (number needed to harm – liczba osób, leczonych przez określony czas, u których wystąpił niekorzystny punkt końcowy leczenia) wynosi 81 dla ASA + klopidogrel, 45 dla ASA + warfaryna, 15 dla klopidogrel + warfaryna i 12 dla terapii potrójnej.52
- W wytycznych ESC zaleca się dalsze skrócenie fazy potrójnej terapii po PCI, zarówno u pacjentów z OZW, jak i z przewlekłym zespołem wieńcowym.28,53
- Przewlekły zespół wieńcowy (niezależnie od wybranego stentu):
- 1 tydzień terapii potrójnej, następnie odstawienie ASA
- OAC + klopidogrel przez 6 miesięcy
- następnie wyłącznie OAC.
- OZW (niezależnie od wybranego stentu)
- 1 tydzień terapii potrójnej, następnie odstawienie ASA
- OAC + klopidogrel przez 12 miesięcy
- następnie wyłącznie OAC.
- Przewlekły zespół wieńcowy (niezależnie od wybranego stentu):
- Potrójna terapia z antagonistą witaminy K lub NOAC (doustne leki przeciwzakrzepowe nowej generacji)
- W terapii potrójnej, przy doustnym leczeniu przeciwkrzepliwym acenokumarolem/ warfaryną, INR powinien mieścić się w przedziale 2–2,5.
- Potrójna terapia z NOAC budzi kontrowersje.
- W wytycznych ESC preferuje się łączenie NOAC z lekami przeciwpłytkowymi w miejsce skojarzenia z antagonistami witaminy K.53
Zmiana leków przeciwpłytkowych
- W razie zastąpienia jednego leku przeciwpłytkowego innym, w wytycznych DEGAM zaleca się następujące postępowanie:
- Zmiana z klopidogrelu na tikagrelor
- Odstawienie klopidogrelu na 1–3 dni, następnie zmiana na tikagrelor.
- Zmiana z prasugrelu na klopidogrel
- Można przejść na zwykłą dawkę podtrzymującą klopidogrelu bez przerwy w terapii.
- Zmiana z prasugrelu na tikagrelor
- Można przejść na zwykłą dawkę podtrzymującą tikagreloru bez przerwy w terapii.
- Zmiana z tikagreloru na klopidogrel
- Dawka nasycająca 300 mg klopidogrelu, następnie zwykła dawka podtrzymująca 75 mg klopidogrelu dziennie.
- Zmiana z klopidogrelu na tikagrelor
Inna farmakologiczna profilaktyka wtórna/zmiana stylu życia
- Zobacz również artykuł wtórna profilaktyka chorób wieńcowych.
- Terapia statynami
- Terapię statynami należy rozpocząć jak najwcześniej po OZW i stosować długotrwale.28,32
- Intensyfikacja terapii powinna rozpocząć sie już w czasie hospitalizacji (rozważyc także dodanie ezetymibu)
- Istnieją poglądy, że zalecane przez towarzystwa kardiologiczne wartości docelowe LDL nie są poparte wystarczającymi dowodami, stąd niektórzy proponują strategię stałej dawki:
- Przepisanie statyny w wysokiej dawce bez dalszych badań kontrolnych.
- Stosowanie innych substancji tylko w przypadku nietolerancji statyn
- jeśli terapia statyną w wysokiej dawce nie jest tolerowana, można zastosować ezetymib, inhibitory PCSK9, kwas bempediowy.
-
- Polskie wytyczne postępowania w dyslipidemii rekomendują:54
- W prewencji wtórnej u pacjentów z grupy bardzo dużego ryzyka sercowo–naczyniowego zmniejszenie stężenia LDL–C do wartości <1,4 mmol/l (<55 mg/dl) i o ≥50% w stosunku do wartości wyjściowej.
- U pacjentów po OZW rozważenie jako wartość docelową stężenie LDL–C <1,0 mmol/l (<40 mg/dl).
- Jeśli cele nie zostaną osiągnięte przy maksymalnej tolerowanej dawce statyny, zaleca się skojarzenie z ezetymibem i dalej z inhibitorem PCSK9.
- Polskie wytyczne postępowania w dyslipidemii rekomendują:54
- Beta–blokery
- Przyjęto, że beta–blokery stosuje się rutynowo, zwłaszcza u pacjentów po STEMI.32
- Beta–blokery są zdecydowanie wskazane w przypadku LVEF ≤40% i/lub objawów niewydolności serca.28,32
- Inhibitory ACE
- Inhibitory ACE są wskazane przy dysfunkcji lewej komory i/lub objawach niewydolności serca lub w nadciśnieniu.28,32
- Zawał mięśnia sercowego nie jest sam w sobie wskazaniem do stosowania inhibitorów ACE, jeśli ciśnienie tętnicze nie jest podwyższone, a w ECHO nie wykazano upośledzonej kurczliwości serca.
- Antagoniści aldosteronu
- Stosowanie antagonistów aldosteronu jest wskazane w przypadku LVEF ≤40% i/lub objawów niewydolności serca.
- Leki przeciwzapalne2
- Kolchicyna w małej dawce (0,5 mg 1 x dz) może być rozważona jeśli:
- inne czynniki ryzyka nie są wystarczająco kontrolowane
- mimo optymalnej terapii występują kolejne zdarzenia sercowo-maczyniowe
- Kolchicyna w małej dawce (0,5 mg 1 x dz) może być rozważona jeśli:
- Nadciśnienie tętnicze
- Leczenie hipotensyjne z docelowym ciśnieniem tętniczym <140/90 mmHg, a następnie <130/80 jeśli dobrze tolerowane.
- Cukrzyca
- Wszystkich pacjentów z OZW należy poddać badaniom przesiewowym w kierunku cukrzycy, chyba że już ją wykryto.28
- Zasadniczo leczenie zgodne z wytycznymi; uwzględnianie chorób towarzyszących w tym niewydolności serca, przewlekłej choroby nerek i otyłości; w tych przypadkach rozważyć zastosowanie inhibitorów SGLT2 (sodium–glucose co-transporter 2) lub agonistów GLP-1-R (glucagon-like peptide-1 receptor)
- W niektórych grupach pacjentów (osoby starsze, zaawansowana choroba wieńcowa, pacjenci z wieloma chorobami współwystępującymi) należy rozważyć nieco mniej rygorystyczne podejście w osiąganiu celów glikemii (wartość HbA1c 8,0 - 8,5%).
- Pacjentom należy doradzić zmianę stylu życia:
- Szczepionka przeciwko grypie może zmniejszyć ryzyko wystąpienia ciężkich zdarzeń sercowo–naczyniowych.56
Rehabilitacja kardiologiczna
- Szczegółowe informacje znajdują się również w artykule rehabilitacja kardiologiczna.
- Rehabilitację kardiologiczną po OZW należy rozpocząć jak najwcześniej, ale nie później niż 3 miesiące po wypisie ze szpitala.
- Rehabilitacja kardiologiczna prowadzi do poprawy stanu pacjentów w różnych obszarach:57
- niższa śmiertelność
- spadek liczby hospitalizacji
- wzrost odporności
- lepsza jakość życia
- poprawa samopoczucia psychicznego.
- Ważnymi elementami programu rehabilitacji są:
- porady dotyczące aktywności fizycznej, regularny trening na ergometrze58
- doradztwo żywieniowe
- kontrola czynników ryzyka
- ogólne porady zdrowotne
- wpływ na czynniki psychospołeczne
- komponenty społeczno–medyczne.
Przebieg, powikłania i rokowanie
Powikłania
- Duży spadek liczby powikłań dzięki wczesnej rewaskularyzacji, jednak przebyty zawał mięśnia sercowego nadal stanowi istotną przyczynę zachorowalności/śmiertelności.3
- Główne powikłania to:
- Wstrząs kardiogenny.
- Niewydolność serca.
- Powstanie tętniaka
- Aneurysmektomia nie przynosi korzyści.
- Rozwój zaawansowanej niedomykalności zastawki mitralnej
- Spowodowana przez zmienioną konfigurację aparatu zastawkowego/dysfunkcję mięśnia brodawkowatego.
- Tworzenie się skrzepów
- Zakrzepica przyścienna w komorze w okolicy zawału.
- Inne powikłania zakrzepowo–zatorowe.
- Leczenie przeciwkrzepliwe do 6 miesięcy pod kontrolą echokardiograficzną.32
- Arytmia (migotanie komór, częstoskurcz komorowy, blok AV, migotanie przedsionków), nagły zgon sercowy.
- Powikłania mechaniczne
- Pęknięcie mięśnia brodawkowatego z ciężką niedomykalnością zastawki mitralnej.
- Pęknięcie wolnej ściany komory.
- Pęknięcie przegrody.
- Zapalenie osierdzia (pericarditis)
- Wczesne zapalenie osierdzia po zawale mięśnia sercowego (wczesny początek, przemijające).32
- Późne zapalenie osierdzia po zawale mięśnia sercowego (zespół Dresslera) po 1–2 tygodniach.
Przebieg i rokowanie
- Poprawa opieki przedszpitalnej i leczenia szpitalnego doprowadziła w ciągu ostatnich dziesięcioleci do spadku śmiertelności.
- W latach 1994–2006, zależny od wieku i płci spadek śmiertelności szpitalnej o 30–50%.59
- Śmiertelność 30–dniowa po zawale mięśnia sercowego wynosi 7–10%.60
- Ze względu na niższą śmiertelność z powodu wczesnych powikłań, o długoterminowym rokowaniu coraz częściej przesądza rozwój niewydolności serca.3
- Wcześniejsze różnice we wskaźnikach śmiertelności wśród kobiet i mężczyzn (wyższe u mężczyzn) stopniowo się wyrównują.63
- Czynnikami ryzyka gorszego rokowania są: zaawansowany wiek, nadciśnienie tętnicze, cukrzyca, choroba tętnic obwodowych (peripheral arterial disease – PAD) i stan po udarze.63
Dalsze postępowanie
- Pierwsze badania kontrolne 2–4 tygodnie po hospitalizacji z powodu zawału mięśnia sercowego.
- Regularne badanie przez lekarza rodzinnego (co 3–6 miesięcy) u pacjentów z chorobą wieńcową, niezależne od innych koniecznych konsultacji (pogorszenie stanu zdrowia, choroby współwystępujące).
- Opieka realizowana wspólnie przez lekarza rodzinnego i kardiologa u pacjentów z:
- OZW w ciągu ostatniego roku
- niewydolnością serca klasy III–IV według NYHA
- komorowymi zaburzeniami rytmu serca, ICD.
- Skierowanie od lekarza rodzinnego do kardiologa w następujących sytuacjach:
- Nie jest możliwe satysfakcjonujące leczenie objawowe na poziomie opieki podstawowej (zagrożony jest cel terapii mający na celu poprawę jakości życia).
- Nie jest możliwe zastosowanie środków terapeutycznych i innych środków w celu wystarczająco skutecznej poprawy rokowania (zagrożony jest cel terapii mający na celu poprawę rokowania).
- Znaczące pogorszenie rozpoznanej wcześniej niewydolności serca lub jej podejrzenie.
- Nowe, klinicznie istotne arytmie serca.
- U osób po OZW zaleca się jest uczestnictwo w grupie wsparcia dla pacjentów kardiologicznych.
- Należy wdrożyć zasady opieki zorientowanej na pacjenta2:
- uwzględnianie preferencji, potrzeb i wartości pacjenta
- angażowanie pacjenta w podejmowanie decyzji
- informowanie o korzyściach i ryzyku związanym z terapią oraz alternatywnym postępowaniu
- ocenianie dobrostanu psychicznego za pomocą trafnych narzędzi, w razie potrzeby pomoc lub kierowanie do konsultacji psychiatrycznej/psychologicznej
- W Polsce dostępny jest program finansowany przez Narodowy Fundusz Zdrowia (KOS–zawał) – kompleksowa specjalistyczna opieka w zakresie leczenia szpitalnego, ambulatoryjnego i rehabilitacji kardiologicznej,
Informacje dla pacjentów
Materiały edukacyjne dla pacjentów
Zawał mięśnia sercowego
- Zawał mięśnia sercowego.
- Zawał mięśnia sercowego, rehabilitacja.
- Zawał mięśnia sercowego, tromboliza.
- Przezskórna interwencja wieńcowa (PCI).
- Operacja wszczepienia bypassów (CABG).
Porady zdrowotne
- Pełnowartościowa dieta.
- Żywność niskotłuszczowa.
- Dlaczego warto rzucić palenie papierosów i jak to zrobić?
- Trening siłowy – dobry dla serca.
- Nadwaga i redukcja masy ciała – jak to zrobić?
Ilustracje
- Patrz EKG: ostry zawał serca ściany przedniej (STEMI).
- Patrz EKG: ostry zawał serca ściany dolnej (STEMI).
- Patrz EKG: częstoskurcz komorowy przed kardiowersją i po kardiowersji (zawał ściany dolnej).

Zawał, zmiana EKG w czasie
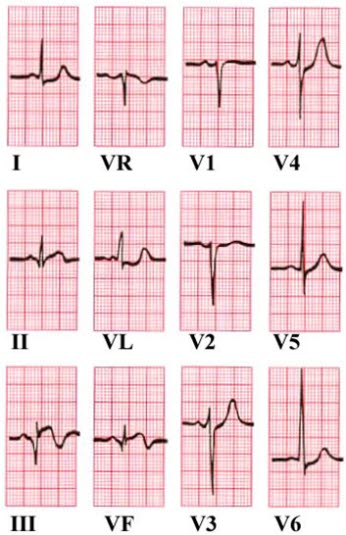
Załamki Q w odprowadzeniu III i aVF. Uniesienie odcinka ST w odprowadzeniu II, III i aVF. Obniżenie odcinka ST w aVL i V6.
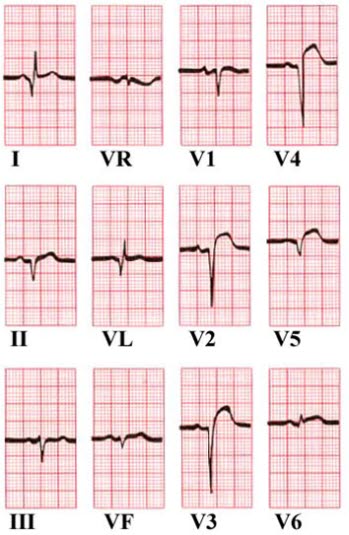
Uniesienie odcinka ST w odprowadzeniach V2–V5
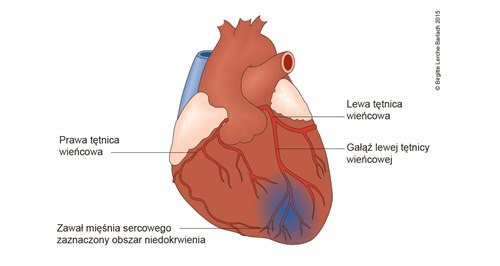
Serce w zawale
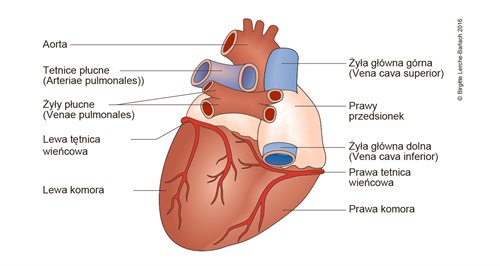
Serce prawidłowe, widok od tyłu
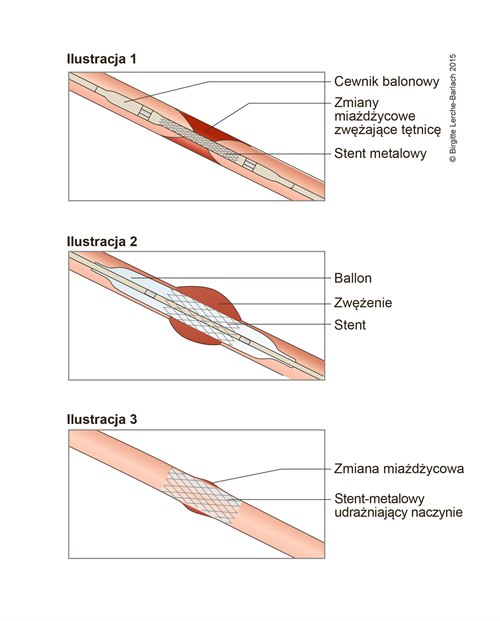
Stentowanie zwężenia naczynia krwionośnego
Źródła
Wytyczne
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), 2023 ESC Guidelines for the management of acute coronary syndromes (Wytyczne postępowania w ostrych zespołach wieńcowych), stan z 2023 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Fourth Universal Definition of Myocardial Infarction (Czwarta uniwersalna definicja zawału serca), stan z 2018 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation (Wytyczne postępowania w ostrym zawale mięśnia sercowego u pacjentów z uniesieniem odcinka ST), stan z 2017 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation (Wytyczne postępowania w ostrych zespołach wieńcowych u pacjentów bez przetrwałego uniesienia odcinka ST), stan z 2020 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Focused update on dual antiplatelet therapy in coronary artery disease developed (Ukierunkowana aktualizacja wytycznych w zakresie podwójnej terapii przeciwpłytkowej w chorobie wieńcowej), stan z 2017 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death (Wytyczne dotyczące postępowania z pacjentami z komorowymi zaburzeniami rytmu i profilaktyki nagłego zgonu sercowego), stan z 2015 roku, www.escardio.org
- European Society of Cardiology (Europejskie Towarzystwo Kardiologiczne, ESC), Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS) (Wytyczne dotyczące rozpoznawania i leczenia migotania przedsionków opracowane we współpracy z Europejskim Stowarzyszeniem Chirurgii Kardio-Torakochirurgicznej), stan z 2020 roku, www.escardio.org
Piśmiennictwo
- Thygesen K., Alpert J., Jaffe A., et al. Fourth universal definition of myocardial infarction (2018), Eur Heart J 2019, 40: 237-69, doi:10.1093/eurheartj/ehy462, DOI
- Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023 Oct 12;44(38):3720-3826. doi: 10.1093/eurheartj/ehad191. Erratum in: Eur Heart J. 2024 Apr 1;45(13):1145. doi: 10.1093/eurheartj/ehad870. PMID: 37622654. PubMed
- Anderson L., Morrow D. Acute Myocardial Infarction, N Engl J Med 2017, 376: 2053-64, doi:10.1056/NEJMra1606915, DOI
- Gąsior M., Poloński L. Zawał mięśnia sercowego w Polsce - gdzie byliśmy, gzie jesteśmy, dokąd zmierzamy, PAN, publikacje.pan.pl
- Bansilal S., Castellano J., Fuster V. Global burden of CVD: focus on secondary prevention of cardiovascular disease, Int J Cardiol 2015, 201: 1-7, doi:10.1016/S0167-5273(15)31026-3, DOI
- Zafari A. Acute Myocardial Infarction, Medscape, aktualizacja: 11.02.2018, dostęp: 23.06.2018, emedicine.medscape.com
- Falk E., Shah P., Fuster V. Coronary Plaque Disruption, Circulation 1995, 92: 657-71, doi:10.1161/01.CIR.92.3.657, DOI
- Shibata T., Kawakami S., Noguchi T., et al. Prevalence, Clinical Features, and Prognosis of Acute Myocardial Infarction Due to Coronary Artery Embolism, Circulation 2015, 132: 241-50, doi:10.1161/CIRCULATIONAHA.114.015134, DOI
- Ertan C., Özpelit M., limon Ö., et al. Vasospastic myocardial infarction: An even rarer occurrence of a rare entity, World J Emerg Med 2017, 8: 68-70, pubmed.ncbi.nlm.nih.gov
- Heusch G., Gersh B. The pathophysiology of acute myocardial infarction and strategies of protection beyond reperfusion: a continual challenge, Eur Heart J 2017, 38: 774-84, doi:10.1093/eurheartj/ehw224, DOI
- Yusuf S., Hawken S., Ôunpuu S., et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study, Lancet 2004, 364: 937-52, doi:10.1016/S0140-6736(04)17018-9, DOI
- Dhingra R., Vasan R. Age as a Cardiovascular Risk Factor, Med Clin North Am 2012, 96: 87-91, www.ncbi.nlm.nih.gov
- Anand S., Islam S., Rosengren A., et al. Risk factors for myocardial infarction in women and men: insights from the INTERHEART study, Eur Heart J 2008, 29: 932-40, doi:10.1093/eurheartj/ehn074, DOI
- Roncaglioni M., Santoro L., D'Avanzo B., et al . Role of Family History in Patients With Myocardial Infarction, Circulation 1992, 85: 2065-72, pmid:1591825, PubMed
- Culic W. Acute risk factors for myocardial infarction, Int J Cardiol 2007, 117: 260-9, doi:10.1016/j.ijcard.2006.05.011, DOI
- Lindhardsen J., Ahlehoff O., Gislason G.H., et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study, Ann Rheum Dis 2011, 70: 929-34, PubMed
- Mehta N.N., Yu Y., Pinnelas R., et al. Attributable risk estimate of severe psoriasis on major cardiovascular events, Am J Med 2011, 124: 775, www.ncbi.nlm.nih.gov
- Olsen A.M., Fosbøl E.L., Lindhardsen J., et al. Long-term cardiovascular risk of NSAID use according to time passed after first-time myocardial infarction, A nationwide cohort study. Circulation 2012, www.ncbi.nlm.nih.gov
- Trelle S., Reichenbach S., Wandel S. et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis, BMJ 2011, 342: c7086, www.bmj.com
- Hsia J., Larson J.C., Ockene J.K., et al. Resting heart rate as a low tech predictor of coronary events in women: prospective cohort study, BMJ 2009, 338: b219, www.ncbi.nlm.nih.gov
- Kwong J.C., Schwartz K.L., Campitelli M.A., et al. Acute myocardial infarction after laboratory-confirmed influenza infection, N Engl J Med 2018, 378(4): 345-53, pmid:29365305, PubMed
- McSweeney J.C., Cody M., Sullivan P., et al. Women's early warning symptoms of acute myocardial infarction, Circulation 2003, 108: 2619-23, www.ncbi.nlm.nih.gov
- Khan N., Daskalopoulou S., Karp I., et al. Sex differences in prodromal symptoms in acute coronary syndrome in patients aged 55 years or younger, Heart 2017, 103: 863-9, doi:10.1136/heartjnl-2016-309945, DOI
- Milner K.A., Vaccarino V., Arnold A.L., et al. Gender and age differences in chief complaints of acute myocardial infarction, Am J Cardiol 2004, 93: 606-8, www.sciencedirect.com
- Dezman Z., Mattu A., Body R., et al. Utility of the History and Physical Examination in the Detection of Acute Coronary Syndromes in Emergency Department Patients, West J Emerg Med 2017, 18: 752-60, www.ncbi.nlm.nih.gov
- Roffi M., Patrono C., Collet J., et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation, Eur Heart J 2016, 37: 267-315, doi:10.1093/eurheartj/ehv320, DOI
- Budaj A., Bednarz B., Leśniak W. Ostre zespoły wieńcowe. Interna- Mały Podręcznik, Medycyna Praktyczna, dostęp: 17.02.2024, www.mp.pl
- Collet J., Thiele H., Barbato E., et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation, Eur Heart J 2020, 00: 1-79, doi:10.1093/eurheartj/ehaa575, DOI
- Ammann P., Pfisterer M., Fehr T., Rickli H. Raised cardiac troponins, BMJ 2004, 328: 1028-9, PubMed
- Maffei E., Seitun S., Martini C., et al. CT coronary angiography and exercise ECG in a population with chest pain and low-to-intermediate pre-test likelihood of coronary artery disease, Heart 2010, 96: 1973-9, PubMed
- Räber L., Kelbæk H., Ostojic M. et al. Effect ofbiolimus-eluting stents with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction: the COMFORTABLE AMI randomized trial, JAMA 2012;308:777–787, PubMed
- Ibanez B., James S., Agewall S., et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation, Eur Heart J 2018, 39: 119-77, doi:10.1093/eurheartj/ehx393, DOI
- Sepehrvand N., James S.K., Stub D., et al. Effects of supplemental oxygen therapy in patients with suspected acute myocardial infarction: a meta-analysis of randomised clinical trials, Heart 29.03.2018, pmid:29599378 PubMed
- Cabello J.B., Burls A., Emparanza J.I., Bayliss S.E., Quinn T. Oxygen therapy for acute myocardial infarction, Cochrane Database of Systematic Reviews Issue 12, pubmed.ncbi.nlm.nih.gov
- Eikelboom J.W., Anand S.S., Malmberg K., Weitz J.I., Ginsberg J.S., Yusuf S. Unfractioned heparin and low-molecular-weight heparin in acute coronary syndrome without ST elevation: a mata analysis, Lancet 2000, 355: 1936-42, PubMed
- Schüpke S., Neumann F.J., Menichelli M. et al for the ISAR-REACT 5 trial investigators. Ticagrelor or Prasugrel in patients with acute coronary syndromes, N Engl J Med, 17.10.2019, 381(16): 1524-34, www.ncbi.nlm.nih.gov
- Bangalore S., Makani H., Radford M, et al. Clinical Outcomes with beta-Blockers for Myocardial Infarction: A Meta-analysis of Randomized Trials. Am J Med. 2014 Oct;127(10):939-53. PubMed
- Kontos M., Diercks D., Ho P., et al. Treatment and outcomes in patients with myocardial infarction treated with acute β-blocker therapy: results from the American College of Cardiology's NCDR(®), Am Heart J 2011, 161: 864-70, doi:10.1016/j.ahj.2011.01.006, DOI
- Schwarzt G., Olsson A., Ezekowitz M., et al. Effects of Atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIACL study, JAMA 2001, 285: 1711-8, www.ncbi.nlm.nih.gov
- Baigent C., Blackwell L., Emberson J., et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials, Lancet 2010, 376: 1670-81, www.ncbi.nlm.nih.gov
- Zijlstra F., Hoorntje J., de Boer M., et al. Long-Term Benefit of Primary Angioplasty as Compared with Thrombolytic Therapy for Acute Myocardial Infarction, New Engl J Med 1999, 341: 1413-9, doi:10.1056/NEJM199911043411901, DOI
- Keeley E., Boura J., Grines C. Primary angioplasty versus intravenous thrombolytic therapy for acute myocardial infarction: a quantitative review of 23 randomised trials, Lancet 2003, 361: 13-20. doi:10.1016/S0140-6736(03)12113-7 DOI
- Armstrong P.W., Gershlick A.H., Goldstein P., et al. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction, N Engl J Med 2013, doi:10.1056/NEJMoa1301092, DOI
- Cantor W.J., Fitchett D., Borgundvaag B., et al, for the TRANSFER-AMI Trial Investigators. Routine early angioplasty after fibrinolysis for acute myocardial infarction, N Eng J Med 2009, 360: 2705-18, www.nejm.org
- McNamara RL, Wang Y, Herrin J, et al, for the NRMI Investigators. Effect of door-to-balloon time on mortality in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2006; 47: 2180-6. PubMed
- De Luca G, Biondi-Zoccai G, Marino P. Transferring patients with ST-segment elevation myocardial infarction for mechanical reperfusion: a meta-regression analysis of randomized trials. Ann Emerg Med 2008; 52: 665-76. PubMed
- Bavry A., Kumbhani D., Rassi A., et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized clinical trials, J Am Coll Cardiol 2006, 48: 1319-25, doi:10.1016/j.jacc.2006.06.050, DOI
- O'Donoghue M., Boden W., Braunwald E., et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction: a meta-analysis, JAMA 2008, 300: 71-80, doi:10.1001/jama.300.1.71, DOI
- Fox K., Clayton T., damman P., et al. Long-term outcome of a routine versus selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data, J Am Coll Cardiol 2010, 55: 2435-45, doi:10.1016/j.jacc.2010.03.007, DOI
- Valgimigli M., Gagnor A., Calabro P., et al. Radial versus femoral access in patients with acute coronary syndromes undergoing invasive management: a randomised multicentre trial, Lancet, 385: 2465-76, doi:10.1016/S0140-6736(15)60292-6, DOI
- Valgimigli M., Bueno H., Byrne R., et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS, Eur Heart J 2018, 39: 213-54, doi:10.1093/eurheartj/ehx419, DOI
- Sørensen R., Hansen M.L., Abildstrom S.Z., et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data, Lancet 2009, 374: 1967-74, PubMed
- Hindricks G., Potpara T., Dagres N., et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS), Eur Heart J 2020, 00: 1-126, doi:10.1093/eurheartj/ehaa612, www.escardio.org
- Banach M., Burchardt P., Chlebus K.. et al. Wytyczne PTL/KLRwP/PTK/PTDL/PTD/PTNT diagnostyki i leczenia zaburzeń lipidowych w Polsce 2021, Lekarz Rodzinny 4/2021 (Suppl), www.termedia.pl
- Choo EH, Chang K, Ahn Y, et al. Benefit of β-blocker treatment for patients with acute myocardial infarction and preserved systolic function after percutaneous coronary intervention. Heart 2013. doi:10.1136/heartjnl-2013-305137 DOI
- Udell J.A., Zawi R., Bhatt D.L., et al. Association between influenza vaccination and cardiovascular outcomes in high-risk patients: a meta-analysis, JAMA 23.1.2013, 310(16):1711-20, PubMed
- Bäck M., Hansen T., Frederix I. European Society of Cardiology. Rehabilitation and exercise training recommendations, 30.06.2017, dostęp: 08.06.2018, www.escardio.org
- Heran B.S., Chen J.M.H., Ebrahim S., Moxham T., Oldridge N., Rees K., Thompson D.R., Taylor R.S. Exercise-based cardiac rehabilitation for coronary heart disease, Cochrane Database of Systematic Reviews 2011, Issue 7. Art. No.: CD001800, DOI: 10.1002/14651858.CD001800.pub2, pubmed.ncbi.nlm.nih.gov
- Vaccarino V., Parsons L., Peterson E.D., et al. Sex differences in mortality after acute myocardial infarction, Arch Intern Med 2009, 169: 1767-74, PubMed
- Chung S., Gedeborg R., Nicholas O., et al. Acute myocardial infarction: a comparison of short-term survival in national outcome registries in Sweden and the UK, Lancet 2014, 383: 1305-12, www.ncbi.nlm.nih.gov
- Schmidt M., Szepligeti S., Horváth-Puhó E., et al. Long-Term Survival Among Patients With Myocardial Infarction Before Age 50 Compared With the General Population, Circ Cardiovasc Qual Outcomes 2016, 9: 523-31, doi:10.1161/CIRCOUTCOMES.115.002661, DOI
- Chapman et al. Association of High-Sensitivity Cardiac Troponin I Concentration With Cardiac Outcomes in Patients With Suspected Acute Coronary Syndrome, JAMA 21.11.2013,, 318(19): 1913-24, www.ncbi.nlm.nih.gov
- Johansson S., Annika Rosengren A., Young K., et al. Mortality and morbidity trends after the first year in survivors of acute myocardial infarction: a systematic review,BMC Cardiovasc Disord 2017, 17: 53, doi:10.1186/s12872-017-0482-9, DOI
Opracowanie
- Katarzyna Kosiek (recenzent)
- Tomasz Tomasik (redaktor)
- Michael Handke (recenzent/redaktor)
- Günther Egidi (recenzent/redaktor)